
Wetenschap
Goud-DNA nanozonnebloemen voor efficiënte genuitschakeling en gecontroleerde transformatie
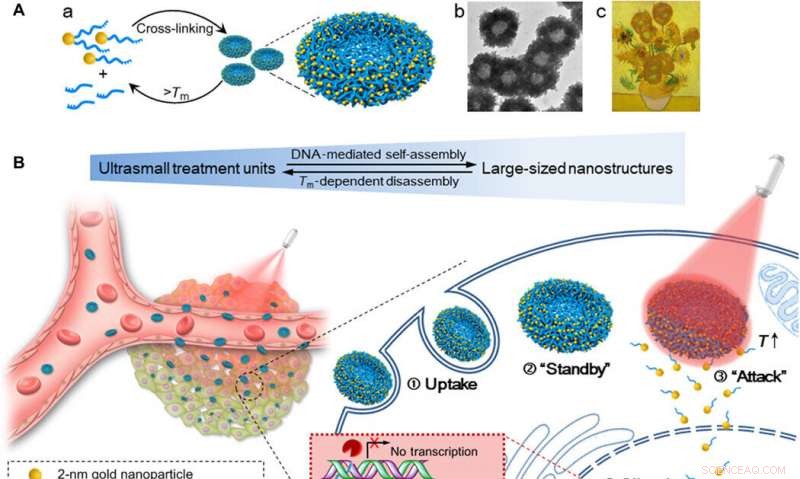
Schema van zelf-geassembleerde goud-DNA nano-zonnebloemen voor verbeterde cellulaire opname, afstembare genuitschakelingseffectiviteit, en gecontroleerd tumorremmingseffect door NIR-bestraling. (A) (a) Montage en demontage van de grote nanostructuur (200-nm goud-DNA nanosunflowers) van/naar ultrakleine nanodeeltjes (2-nm Au-POY2T NP's). (b) Representatief TEM-beeld van de nanosunflowers. (c) Meesterwerk:Zonnebloemen (Vincent van Gogh, 1889). (B) Links:in vivo tumorretentie en penetratie van transformeerbare nanozonnebloemen. Rechts:verbeterde cellulaire opname en gecontroleerd oncogen-uitschakelingsproces van de nanosunflowers in vitro. ① Nanozonnebloemen van groot formaat werden opgenomen door een MCF-7-cel. ② De nanozonnebloemen staan paraat in het celcytoplasma. ③ Na NIR-bestraling, grote goud-DNA-nanostructuren dissociëren en geven kleine eenheden (2-nm Au-POY2T NP's) vrij om de celkern aan te vallen. ④ De silencing-sequentie POY2T zal binden aan de P2-promotor van het c-myc-oncogen en de c-myc-expressie van MCF-7-cellen neerwaarts reguleren, die kan worden gecontroleerd (AAN/UIT) en geregeld (Laag/Medium/Hoog) door de NIR-bestraling. Credit: wetenschappelijke vooruitgang , doi:10.1126/sciadv.aaw6264
Het ontwikkelen van een efficiënt leveringssysteem voor verbeterde en gecontroleerde geneeskundigen op basis van geninterferentie is een bestaande uitdaging in de moleculaire biologie. Het voortschrijdende gebied van nanotechnologie kan een effectieve, interdisciplinaire strategie om de levering van nucleïnezuur te vergemakkelijken. In een nieuw rapport Shuaidong Huo en collega's in de interdisciplinaire afdelingen van Nanoscience, Interactieve materialen, Chemie en polymeeronderzoek in China, Duitsland en de VS gebruikten triplexvormende oligonucleotidesequenties gekoppeld aan de complementaire streng om de zelfassemblage van ultrakleine gouden nanodeeltjes te bemiddelen.
De resulterende zonnebloemachtige nanostructuren vertoonden een sterke nabij-infraroodabsorptie (NIR) en het vermogen tot fotothermische omzetting. Toen de wetenschappers de structuren bestraalden met NIR, de grotere nanostructuren gedemonteerd om ultrakleine nanodeeltjes te genereren die zijn gemodificeerd met de c-Myc-oncogensequentie om zich direct op de kankercelkern te richten. Hu et al. gecontroleerde genuitschakeling door synergetisch de tijd van pre-incubatie van cellen met nanodeeltjes te regelen naast zelfassemblage van nanostructuren (in vitro en in vivo) en het tijdsbestek van NIR-bestraling. De studie bood een nieuw paradigma om efficiënte en op maat gemaakte nanodragers te construeren voor toepassingen van geninterferentie en therapeutische genafgifte.
Gentherapie heeft een groot potentieel om een verscheidenheid aan ziekten en complicaties te behandelen, waaronder onvruchtbaarheid, hiv en kanker. Succesvolle gentherapie om ziektesymptomen te verlichten, hangt af van een efficiënt genafgiftevehikel of vector. Tijdens het proces, de gendrager moet vele biologische barrières en celmembranen passeren en tegelijkertijd ontsnappen aan endosomale insluiting en op nuclease gebaseerde afbraak. In vergelijking met op virussen gebaseerde leveringsstrategieën, benaderingen voor niet-virale genafgifte worden geconfronteerd met veel uitdagingen tijdens het proces van het laden en vrijgeven van DNA/RNA, gerichte levering en intracellulaire opname, inclusief onverenigbaarheid met betrekking tot immuunresponsen in vivo.
Krachtige inspanningen op het gebied van nanotechnologie zijn aan de gang om stabiele en efficiënte voertuigen te ontwikkelen voor genoverdracht naar kankercellen. Vanwege hun unieke fysiochemische eigenschappen zijn er een aantal nanomaterialen ontstaan voor genafgifte. Onder hen, gouden nanodeeltjes (Au NP's) met specifieke grootte en oppervlakte-eigenschappen kunnen in vivo obstakels overwinnen om een van de meest bestudeerde gendragersystemen te worden. Echter, deze strategieën hebben een verscheidenheid aan tekortkomingen ondervonden en daarom is het belangrijk om efficiënte afgiftesystemen of verbeterde en gecontroleerde gentherapieën op te zetten.
Zelfassemblage en testen van zonnebloemachtige nanostructuren
In het huidige werk, Hu et al. werden geïnspireerd door het vermogen van de natuur om DNA te hybridiseren door DNA-gemedieerde, zelf-geassembleerde gouden DNA-nanostructuren (ongeveer 200 nm). Het zonnebloemachtige ontwerp vertoonde sterke NIR-absorptie en fotothermische conversie-eigenschappen. Bij NIR-bestraling, de structuren gedemonteerd om ultrakleine gouden nanodeeltjes (2 nm, Au NP's) met potentieel voor oncogene silencing, verbeterde cel- en kernpermeabiliteit en verbeterde transfectie-efficiëntie. De wetenschappers controleerden synergetisch de cel-nanomateriaal-interacties op basis van de tijd van pre-incubatie in het laboratorium, gevolgd door de circulatietijd in vivo en de tijdlijn van de bestraling. De experimenten faciliteerden een verhoogde cellulaire opname, afstembare gen-uitschakelingseffectiviteit en gecontroleerde tumorremming. De transformeerbare nanosunflowers vormden een uitstekend model om nanovoertuigen te ontwerpen voor medicijnafgifte met een groot potentieel in de biogeneeskunde.
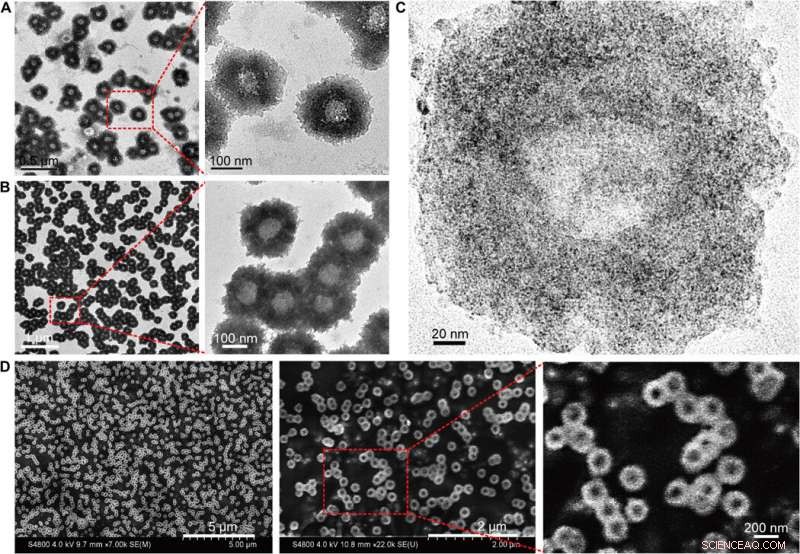
Morfologische karakterisering van de zelf-geassembleerde nanostructuren (nanozonnebloemen). (A) TEM (200 kV) afbeeldingen van de nanosunflowers met vergrote structurele details. (B) Bio-TEM (80 kV) beelden met vergrote polymeer structurele details. (C) TEM-afbeeldingen met hoge resolutie (200 kV) die de verdeling van ultrakleine NP's op de zelf-geassembleerde nanostructuur tonen. (D) SEM-afbeeldingen met vergrote oppervlaktetopografie van de nanosunflowers. Krediet:wetenschappelijke vooruitgang, doi:10.1126/sciadv.aaw6264
Hu et al. synthetiseerde eerst de Au NP's van twee nanometer gecoat met tiopronine en gemodificeerde ze met thiol-oligonucleotiden (SH-POY2T) met behulp van een gevestigde methode van liganduitwisseling. Het 23-nucleotide (nt) POY2T-oligonucleotide bond de P2-promoter van het c-myc-oncogen om een triplexstructuur te vormen en de oncogene c-myc-expressie neerwaarts te reguleren. parallel, ze ontwierpen en synthetiseerden een andere enkelstrengs sequentie die bekend staat als CA om complementair te hybridiseren met de staart van de POY2T-sequentie en de binding ervan aan het c-myc-oncogen te blokkeren. Ter afronding, de nanostructuur zelf geassembleerd tot zonnebloemachtige structuren. Het team onderzocht de nanostructuur (200 nm) met behulp van transmissie-elektronenmicroscopie (TEM). Aanvullende beeldvorming onthulde verdere details van de DNA-delen van de "zonnebloem" -structuur. Toen de materiaalwetenschappers scanning-elektronenmicroscopie (SEM) gebruikten om de TEM-resultaten te valideren, ze observeerden consistentie tussen de methoden.
Ze onderzochten de UV-Vis-absorptiespectra van de ultrakleine Au NP's voorafgaand aan DNA-gemedieerde zelfassemblage. De monodisperse, individuele Au-POY2T NP's van twee nanometer vertoonden een sterke absorptie in het NIR-gebied om warmte te genereren onder NIR-straling. Hu et al. crediteerde de waargenomen sterke NIR-absorptie om de interdeeltjesafstand en niet-uniforme ruimtelijke verdeling van individuele NP's binnen de grotere nanostructuur te verkleinen. Ze testten de hitterespons van de zelf-geassembleerde nanostructuren onder NIR-bestraling en noteerden het smeltpunt van de complementaire DNA-sequenties (POY2T en CA) tot ongeveer 41 graden C, dissociëren van de helft van de duplexstructuur tussen complementaire DNA-sequenties. Hu et al. 10 minuten geselecteerd als de optimale tijd voor NIR-bestraling in het onderzoek.
Onderzoek naar fotothermische eigenschappen en demontagegedrag van de zelf-geassembleerde nanostructuren. (A) Zichtbare absorptiespectra van 2-nm core-sized NP's en 200-nm zelf-geassembleerde nanostructuren. a.u., absorptie eenheid. (B) Temperatuurrespons van zelf-geassembleerde nanostructuren, bij NIR-bestraling, gedispergeerd in water en celkweekmedium. Gemiddelde waarden ± SD, n =3. (C) Temperatuurstijging van zelf-geassembleerde nanostructuren, bij NIR-bestraling, gedispergeerd in water en celkweekmedium. (D) Verandering van maximale absorptie (767 nm) van 2-nm core-sized NP's en 200-nm zelf-geassembleerde nanostructuren bij NIR-bestraling. (E en F) TEM-observatie van demontagegedrag van 200-nm zelf-geassembleerde nanostructuren voor (boven) en na (onder) NIR-bestraling (808 nm, 10 minuten). (G) Hydrodynamische diameter van (a) monodisperse 2-nm Au-POY2T NP's en grootteverandering van de 200 nm nanosunflowers voor (b) en na (c en d) NIR-bestraling voor verschillende tijdsperioden (3 en 10 min). Krediet:wetenschappelijke vooruitgang, doi:10.1126/sciadv.aaw6264 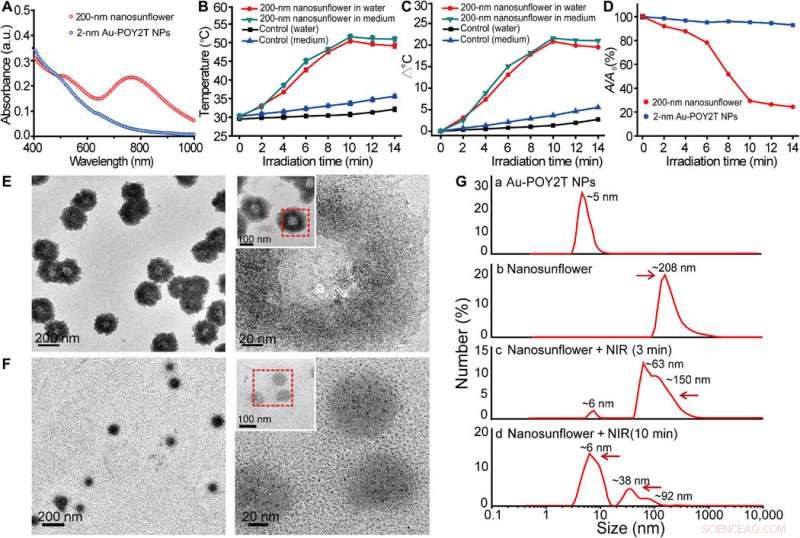
De wetenschappers veronderstelden dat de zelf-geassembleerde nanostructuren zouden krimpen en uiteenvallen in individuele ultrakleine Au-POY2T NP's. Na 10 minuten NIR-bestraling, de maximale absorptie (767 nm) van nanostructuren nam aanzienlijk af om de zonnebloemstructuur te demonteren. Ze volgden de experimenten voor en na NIR-bestraling met TEM-waarnemingen en gebruikten deeltjesgrootte-analysatoren om het demontageproces en de groottetransformatie van de nanostructuren tot zes nanometer groot te begrijpen en bevestigden de optimale geschiktheid van de tijdlijn van 10 minuten.
Hu et al. paste NIR-bestraling toe op MCF-7-cellen die waren behandeld met zelf-geassembleerde gouden DNA-nanostructuren en testte hun cellulaire opname in vitro als proof-of-concept. Ze bepaalden de cellulaire internalisatie van Au-POY2T (2 nm) over verschillende incubatietijden en kwantificeerden hun cellulaire opname met behulp van inductief gekoppelde plasma-massaspectroscopie (ICP-MS) en eerdere methoden. Ze merkten een verhoogde internalisatie op na zes uur incubatie in vergelijking met 24-uurs incubatietijdlijnen. Ze hebben geen remmers van endocytose waargenomen om de opname van Au-POY2T NP te beïnvloeden, suggereert de betrokkenheid van een alternatief pad zoals membraanfusie.
Het gen-uitschakelingsgedrag van de zelf-geassembleerde nanostructuren begrijpen
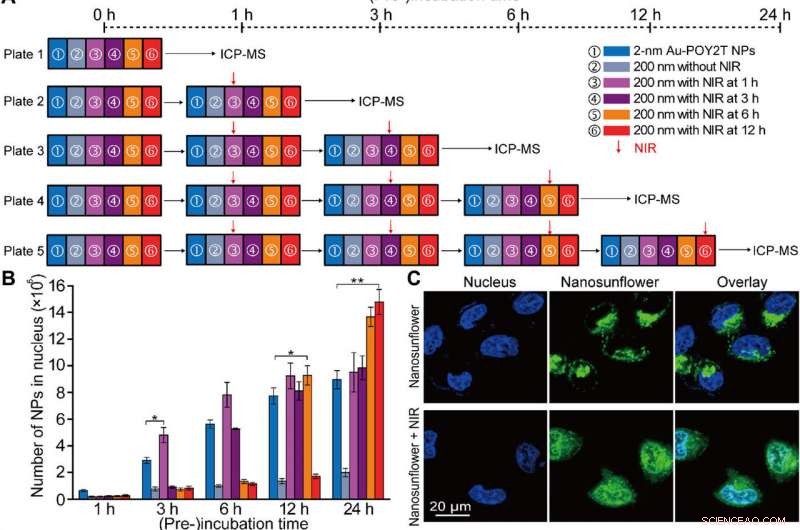
Gecontroleerde kernlokalisatie en gen-uitschakelingsstudie in vitro van de zelf-geassembleerde nanostructuren. (A) Schema van de in vitro cel experimentele opstelling voor de gecontroleerde NP-kernlokalisatie en genregulatiestudie. (B) Aantal 2-nm Au-POY2T NP's gelokaliseerd in de MCF-7-celkern met behandeling van ① individuele 2-nm Au-POY2T NP's, ② 200 nm nanozonnebloemen, en 200 nm nanozonnebloemen met NIR-bestraling (10 min) na verschillende pre-incubatietijden (③ 1, 3, 6, en ⑥ 12 uur). Gemiddelde waarden ± SD, n =3. Statistische verschillen werden bepaald door tweezijdige Student's t-test; *P <0,05 en **P <0,01. (C) Confocale observatie van de distributie van fluoresceïne-isothiocyanaat-gelabelde nanosunflowers (groen) voor (boven) en na (onder) NIR-bestraling in MCF-7-cellen. Nucleus werd gelabeld door 4′, 6-diamidino-2-fenylindol (blauw). (D) Bio-TEM-beeld van de lokalisatie van grote nanozonnebloemen (boven, rode pijl) in het cytoplasma en verdeling van vrijgekomen kleine NP's (onder, blauwe pijl) in cytoplasma en kern na NIR-bestraling in MCF-7-cellen. (E) Cytotoxiciteitsevaluatie van MCF-7-cellen met behandeling van 200 nm nanosunflowers na NIR-bestraling (na een periode van pre-incubatietijd:1, 3, 6, en 12 uur, respectievelijk) vergeleken met controle, 2-nm Au-TIOP NP's, POY2T-reeks, CA-reeks, 2-nm Au-POY2T NP's, 200 nm nanozonnebloemen zonder NIR-bestraling, en alleen blootstelling aan NIR. Alle concentraties van behandelingen waren op of gelijk aan 1 M in POY2T-sequentie en werden getest na in totaal 24 uur incubatie. Gemiddelde waarden ± SD, n =3. Statistische verschillen werden vergeleken met de behandelingsgroep van ① individuele 2-nm Au-POY2T NP's bepaald door tweezijdige Student's t-test; *P <0,05 en **P <0,01. (F) C-myc mRNA-niveau bepaald door real-time PCR na verschillende behandelingen zoals hierboven beschreven. Gemiddelde waarden ± SD, n =3. Statistische verschillen werden bepaald door tweezijdige Student's t-test; **P <0,01 en ***P <0,001. (G) C-myc-eiwitniveaus bepaald door Western-blot en (H) overeenkomstig kwantitatief histogram na verschillende behandelingen zoals hierboven beschreven. GAPDH, glyceraldehydefosfaatdehydrogenase. Krediet:wetenschappelijke vooruitgang, doi:10.1126/sciadv.aaw6264
Na verbeterde cellulaire opname van zelf-geassembleerde nanostructuren in vitro, het onderzoeksteam onderzocht de verdeling van nanodeeltjes in de celkernen met behulp van "stand-by" en "aanval" -strategieën na NIR-triggering. Voor deze, ze extraheren celkernen na incubatie, voor ICP-MS-analyse na NIR-bestraling over verschillende incubatieperiodes (één, drie, zes en twaalf uur). Ze merkten op dat de pre-incubatieperiode grotendeels de internalisatie van nanodeeltjes in de celkern beïnvloedt, en de onderzoekers reguleerden Au-POY2T NP's in de celkern op basis van de tijd van pre-incubatie en NIR-bestraling.
Hu et al. onderzocht ook NIR-bestraling gecontroleerde therapeutische effecten van nanosunflowers met behulp van cellevensvatbaarheidstesten; ze zagen oncogene silencing aanzienlijk toenemen (80 procent) en meer kankercellen doden. Het onderzoeksteam controleerde de therapeutische impact effectief door de tijdlijn van pre-incubatie en bestraling efficiënt te veranderen. De resultaten ondersteunden een superieur vermogen van de transformeerbare nanozonnebloemen om het c-myc-oncogen en oncoproteïne tot zwijgen te brengen. De wetenschappers controleerden het genuitschakelingsproces door pre-incubatietijdlijnen voorafgaand aan NIR-bestraling af te stemmen.
Remming van tumorgroei beheersen met zelf-geassembleerde nanozonnebloemen
Om de controleerbare anti-tumor efficiëntie van nanosunflowers in vivo te testen, de wetenschappers onderzochten eerst hun bloedcompatibiliteit om de goede biocompatibiliteit van bloed te bevestigen. Het onderzoeksteam stelde vervolgens het MCF-7-tumormodel op met behulp van de naakte BALB/c-muizen, liet de tumorvolumes 50 mm . bereiken 3 en verdeelde de dieren willekeurig in negen groepen en behandelde ze met 1000 µl van verschillende POY2T-formuleringen. Na elke injectie, ze bestraalden de diergroepen gedurende 10 minuten met NIR-lasers om een lokale temperatuur boven 41 ° C te bereiken.
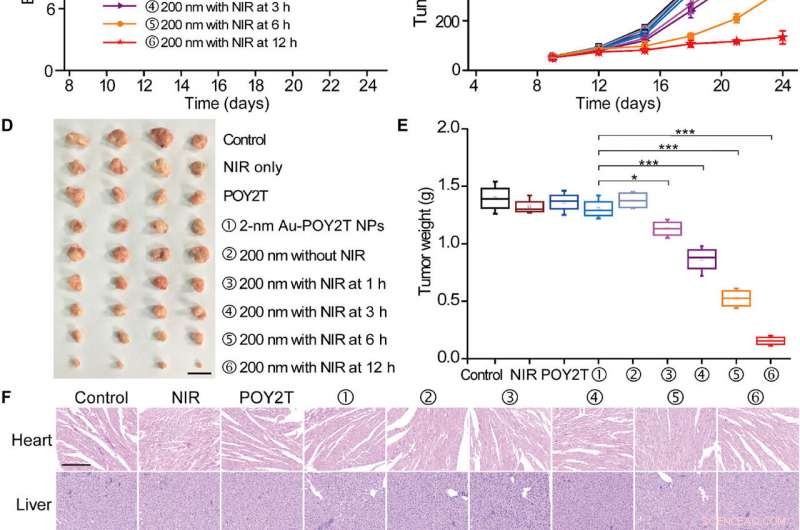
Gecontroleerde tumorgroeiremmingsstudie van de zelf-geassembleerde nanostructuren. (A) Het MCF-7-tumor BALB/c-model van naakte muizen werd vastgesteld op dag 0. Nadat de tumoren klaar waren, de muizen werden willekeurig verdeeld in negen groepen en behandeld met 100 l van verschillende formuleringen (equivalent aan 10 μM in POY2T-sequentie; groep ① met 2-nm Au-POY2T NP's en groepen ②, ik, ik, ik, en ⑥ met 200 nm nanozonnebloemen) op dag 9, 12, en 15. In groepen ③, ik, ik, en ik, de tumoren werden bestraald met een NIR-laser gedurende 10 minuten op 1, 3, 6, en 12 uur na elke intraveneuze injectie. Zoutoplossing, alleen NIR, en POY2T werden gebruikt als controlegroepen. De (B) lichaamsgewichten en (C) tumorvolumes werden elke 3 dagen gemeten. Schaalbalk, 1cm. Nadat de muizen op dag 24 waren opgeofferd, alle tumoren werden (D) geïsoleerd en (E) gewogen, respectievelijk. Gemiddelde waarden ± SD, n =4. Statistische verschillen werden bepaald door een tweezijdige Student's t-test; *P <0,05, **P <0,01, en ***P <0,001. (Fotocredit:Ningqiang Gong, Nationaal centrum voor nanowetenschap en technologie, China.) (F) Hematoxyline- en eosinekleurende afbeeldingen van organen, waaronder het hart, lever, milt, long, nier, en tumor na verschillende behandelingen. Schaalbalk, 200 m. Krediet:wetenschappelijke vooruitgang, doi:10.1126/sciadv.aaw6264
Van belang, muizen behandeld met de met nanozonnebloem behandelde groep en bestraald na 12 uur vertoonden de meest significante antitumoreffecten, wat wijst op efficiënte levering van gen-uitschakelingseenheden in de tumorplaats. Na 24 dagen, Hu et al. offerde de dieren, isoleerde de tumoren en wogen ze om op nanozonnebloem gebaseerde NIR-gecontroleerde tumorgroeiremming in vivo aan te tonen. Op basis van histologische studies, het team toonde aan dat de behandeling de tumorgroei significant verminderde en de morfologie van andere organen niet beïnvloedde. De resultaten bevestigden de therapeutische efficiëntie en het ontbreken van bijwerkingen voor nanosunflowers en NIR-therapie.
Op deze manier, Shuaidong Huo en collega's ontworpen, ontwikkelde en geoptimaliseerde nanoagentia voor effectieve antitumortherapie. Ze ontwierpen zelf-geassembleerde zonnebloemachtige nanostructuren om te fungeren als dragers van meerdere deeltjes geladen met veel ultrakleine therapeutische eenheden. Bij NIR-bestraling, de nanostructuren dissocieerden om zwermen kleine NP's vrij te geven om zich op de celkern te richten. Bij tumordragende muizen de grote zonnebloemen richtten zich passief op de tumorplaats gevolgd door NIR-bestraling om de genetische samenstelling van de tumor te transformeren en te verkleinen. Het onderzoeksteam streeft ernaar de transfectie-efficiëntie te verbeteren en een blauwdruk te bieden voor controleerbare gen-uitschakeling op tumorlocaties met behulp van transformeerbare geninterferentiedragers voor ingewikkelde theranostica op het niveau van de enkele cel.
© 2019 Wetenschap X Netwerk
 Cryo-elektronenmicroscopie werpt nieuw licht op batterijen
Cryo-elektronenmicroscopie werpt nieuw licht op batterijen Welk nieuw gebruik wordt er gevonden voor zeldzame aarde-elementen?
Welk nieuw gebruik wordt er gevonden voor zeldzame aarde-elementen?  Synthetisch molecuul dringt dubbelstrengs DNA binnen
Synthetisch molecuul dringt dubbelstrengs DNA binnen Nieuwe methode versnelt ontwikkeling medicatie
Nieuwe methode versnelt ontwikkeling medicatie Vloeibare metalen breken organische brandstoffen af tot ultradunne grafietplaten
Vloeibare metalen breken organische brandstoffen af tot ultradunne grafietplaten
 Tropische boomwortels vertegenwoordigen een ondergewaardeerde koolstofpool
Tropische boomwortels vertegenwoordigen een ondergewaardeerde koolstofpool NASA ziet windschering van invloed zijn op tropische storm Yagi
NASA ziet windschering van invloed zijn op tropische storm Yagi Watergebruiksstrategieën voor bomen kunnen droogtes verergeren
Watergebruiksstrategieën voor bomen kunnen droogtes verergeren Opwarming van de aarde is verantwoordelijk voor verdrievoudiging van extreme West-Afrikaanse Sahel-stormen, studie toont
Opwarming van de aarde is verantwoordelijk voor verdrievoudiging van extreme West-Afrikaanse Sahel-stormen, studie toont Klimaatnetwerk detecteert voorloper van faseovergang Pacific Decadal Oscillation
Klimaatnetwerk detecteert voorloper van faseovergang Pacific Decadal Oscillation
Hoofdlijnen
- De droge gebieden van Californië zijn hotspots van plantendiversiteit
- De productie van recombinante menselijke groeihormonen door Recombinant DNA Technology
- Celmuursamenstelling van de zes koninkrijken
- Hoe dopamine helpt om sommige voedingsmiddelen verslavend te maken
- Een model van een plantencel in een plastic zak maken
- Oude Egyptische zwangerschapstest overleefde millennia omdat het werkte
- Waar bevindt zich DNA in plantencellen?
- Hoe zijn fotosynthese en cellulaire ademhaling gerelateerd
- Leeftijd van moeders beïnvloedt genetische overeenkomst tussen tweelingen
- Lichtgevende nanokristaldiodes gaan ultraviolet:potentieel van biomedische apparaten voor robuust, implanteerbaar product

- Nanotechnologische innovaties kunnen waterzuivering verbeteren

- Kunnen we meer goedaardige nanomaterialen vinden?
- Hoe laag kunnen we gaan? Nanoporiëndetectie van enkelvoudige griepvirussen om uitbraken onder controle te houden

- Nanokristallen beïnvloeden het lot van stamcellen tijdens botvorming
 Energieoogst en innovatieve inputs markeren gadgets voor technische shows
Energieoogst en innovatieve inputs markeren gadgets voor technische shows In vitro/in silico-evaluaties van bindingsaffiniteiten van perfluoralkylstoffen aan Baikal-afdichting PPARα
In vitro/in silico-evaluaties van bindingsaffiniteiten van perfluoralkylstoffen aan Baikal-afdichting PPARα Een model maken van een maansverduistering en een zonsverduistering
Een model maken van een maansverduistering en een zonsverduistering Chilenen krijgen verkeerde tsunamiwaarschuwing na aardbeving op Antarctica
Chilenen krijgen verkeerde tsunamiwaarschuwing na aardbeving op Antarctica Nieuw model voor stabiliteit van Fannie Mae en Freddie Mac
Nieuw model voor stabiliteit van Fannie Mae en Freddie Mac Maanbevingen tuimelen rotsblokken, maanstaarten bouwen
Maanbevingen tuimelen rotsblokken, maanstaarten bouwen De Atlantische Oceaan krijgt misschien een vliegende start vanaf de andere kant van de wereld
De Atlantische Oceaan krijgt misschien een vliegende start vanaf de andere kant van de wereld Stappen in leren hoe te doen Lange divisie met basen anders dan 10
Stappen in leren hoe te doen Lange divisie met basen anders dan 10
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

