
Wetenschap
Onderzoekers kijken naar de natuur om kanker te verslaan
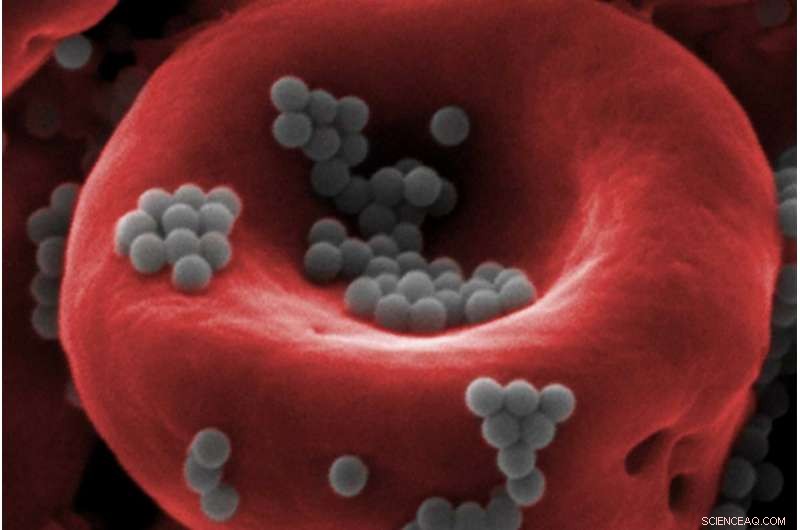
Nanodeeltjes (grijs) die aan een rode bloedcel zijn bevestigd, kunnen aan detectie door de lever en milt van het lichaam ontsnappen, de weg vrijmaken voor effectievere, minder giftige medicijnafgifte. Krediet:Wyss Institute aan de Harvard University
Elk jaar, meer dan 18 miljoen mensen over de hele wereld wordt verteld, "Je hebt kanker." In de VS, bijna de helft van alle mannen en meer dan een derde van de vrouwen zal tijdens hun leven een vorm van kanker krijgen, en 600, Jaarlijks sterven er meer dan duizend aan. Ondanks de miljarden dollars en talloze nieuwe behandelingen die erop zijn gegooid sinds president Richard M. Nixon in 1971 de 'oorlog' aan de ziekte verklaarde, kanker weigert te verslaan.
Waarom blijft het zo'n geduchte vijand? Ten slotte, het is al sinds de tijd van Nixon bekend dat niet-herstelde genetische schade ervoor kan zorgen dat cellen ongecontroleerd groeien, die wordt gezien als de oorzaak van kanker. Maar dit inzicht heeft niet de weg gewezen naar een voor de hand liggende behandeling. Onderzoek naar kankerbiologie heeft aangetoond dat het om verschillende redenen een van de meest complexe en verraderlijke ziekten bij de mens is.
Eerst, kanker kan worden veroorzaakt door een aantal factoren, van virale infecties tot blootstelling aan kankerverwekkende chemicaliën tot eenvoudig genetisch pech. De longkanker van de ene patiënt kan worden veroorzaakt door een geheel andere constellatie van mutaties dan die van een andere, en een medicijn dat op een bepaald mutatieprofiel is gericht, komt slechts een subgroep van patiënten ten goede. Verder, kankercellen ontwikkelen vaak spontaan nieuwe mutaties, het beperken van de effectiviteit van genetisch gerichte medicijnen.
Tweede, kanker wordt veroorzaakt door een storing in de lichaamseigen cellen, dus het is moeilijk om medicijnen te ontwerpen die zich alleen op kankercellen richten en gezonde cellen sparen.
Derde, terwijl genetische mutaties de vorming van kanker kunnen stimuleren, kankers kunnen stoppen met groeien en jarenlang inactief blijven, wat suggereert dat er meer factoren in het spel zijn dan alleen genmutatie.
En tenslotte, kanker heeft een aantal verschillende "trucs" waardoor het zich kan verbergen voor het zeer waakzame immuunsysteem van het lichaam, laat het onopgemerkt en ongecontroleerd groeien totdat, vaak, het is te laat.
Behandelingsregimes voor kanker in de 19e en 20e eeuw waren grotendeels beperkt tot een agressief driemanschap van chirurgie, straling, en chemotherapie, die allemaal traumatische bijwerkingen hebben en patiënten op de rand van de dood kunnen brengen in de naam van het redden van hun leven. Aangezien onze kennis van de ziekte in de loop van de decennia genuanceerder is geworden, een paradigmaverschuiving heeft plaatsgevonden in het veld, gericht op de erkenning dat het aanvallen van een complexe ziekte met botte instrumenten niet de meest effectieve aanpak is. Een golf van nieuwe therapeutische strategieën, waaronder immunotherapie, nanotechnologie, en gepersonaliseerde geneeskunde - geeft hoop aan patiënten voor wie traditionele behandelingen hebben gefaald en biedt het potentieel van langdurige genezingen.
Wetenschappers van het Wyss Institute for Biologically Inspired Engineering met expertise op gebieden variërend van moleculaire celbiologie en immunologie tot materiaalwetenschap, chemische technologie, mechanobiologie, en DNA-origami lopen voorop in verschillende van deze nieuwe benaderingen. Hun onderzoek, verenigd door het gemeenschappelijke principe van het navolgen van de natuur, heeft het potentieel om bestaande behandelingen beter te maken, nieuwe maken, en zelfs voorkomen dat kanker überhaupt begint.
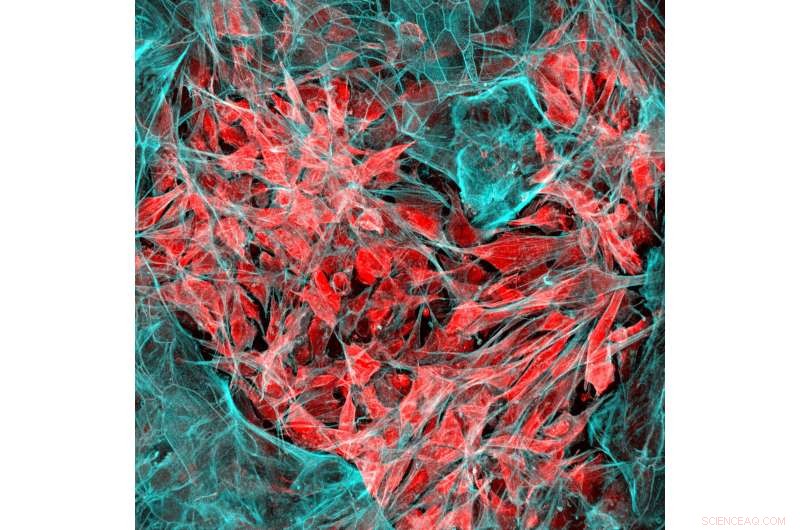
Longkankercellen (rood) die menselijk longweefsel binnendringen (blauw). Krediet:Wyss Institute aan de Harvard University
Betere medicijnafgifte zit ons in het bloed
Chemotherapie is de afgelopen halve eeuw de ruggengraat van de kankerbehandeling geweest, omdat het medicijnen in de bloedbaan brengt om snel delende kankercellen door het hele lichaam te doden. Echter, omdat chemotherapie zich systemisch richt op alle snelgroeiende cellen, het kan ook de darmen beschadigen, beenmerg, huid, haar, en andere delen van het lichaam, en in sommige gevallen moet het in zo'n hoge dosis worden gegeven dat de patiënt er tijdens de behandeling bijna aan sterft. Pogingen om chemotherapiemedicijnen minder toxisch te maken, omvatten het inkapselen ervan in nanodeeltjes die ze pas vrijgeven wanneer ze hun beoogde locatie bereiken, maar minder dan 1 procent van de in nanodeeltjes ingekapselde medicijnen bereikt daadwerkelijk hun doelen, zoals de menselijke lever en milt ze agressief uit het bloed filteren.
Samir Mitragotri, een kernfaculteitslid van het Wyss Institute, besloten om chemische technologie toe te passen op het probleem om medicijnen lang genoeg in de bloedbaan te houden om hun werk te doen. Het eerste waar hij mee te maken kreeg, was dat rode en witte bloedcellen meerdere keren per dag door het bloed circuleren, schijnbaar ontsnappen aan detectie en vernietiging door de lever en de milt.
"Ik dacht, 'Als deze cellen van nature niet uit de bloedbaan worden verwijderd, misschien kunnen we ze gebruiken om de nanodeeltjes daar ook te laten blijven, in plaats van een nieuwe en dure vermomming te creëren om de nanodeeltjes te beschermen, '" zei Mitragotri, de Hiller Professor of Bioengineering en Hansjörg Wyss Professor of Biologically Inspired Engineering aan de Harvard John A. Paulson School of Engineering and Applied Sciences (SEAS).
Mitragotri's laboratorium ontdekte dat nanodeeltjes die aan rode bloedcellen zijn gehecht inderdaad worden genegeerd door de lever en milt bij muizen. en de nanodeeltjes worden afgeschoven en afgezet in weefsels wanneer de bloedcellen de bijzonder strakke knijpen door de kleine haarvaten die bloed aan organen leveren. Door bloedcelgebonden nanodeeltjes te injecteren in een bloedvat direct stroomopwaarts van de menselijke longen, de onderzoekers waren in staat om 41 procent van hen te laten accumuleren in het longweefsel - veel meer dan de gebruikelijke 1 procent.
"Gewoon door te veranderen in welk bloedvat we de nanodeeltjes injecteren, we kunnen een veel hogere dosis van een medicijn afgeven aan het beoogde orgaan, en vertrouw op het natuurlijke reinigingsmechanisme van het lichaam om alle deeltjes te verwijderen die het doel niet bereiken. We kunnen zelfs wat nanodeeltjes krijgen om de hersenen te targeten, ' zei Mitragotri.
Ondanks zijn slechte reputatie, chemotherapie zal waarschijnlijk niet snel ergens heen gaan, omdat uit onderzoek is gebleken dat nieuwe therapieën het beste werken in combinatie met chemotherapie. Maar technologieën zoals bloedcelgebonden nanodeeltjes kunnen helpen de dosis te verlagen die moet worden toegediend en de werkzaamheid van chemotherapie verhogen, het verbeteren van de kwaliteit van leven van kankerpatiënten wereldwijd.
Mitragotri heeft ook succes gevonden door deze "rugzak"-strategie van nanodeeltjes toe te passen op witte bloedcellen, monocyten genaamd, die zich differentiëren in immuuncellen, macrofagen genaamd, die ziekten, waaronder kanker, bestrijden. Niet alleen zijn monocyten in staat om hun medicijnladingen met nanodeeltjes met zich mee te dragen terwijl ze weefsels infiltreren (wat zou kunnen helpen bij het afleveren van medicijnen aan tumoren diep in de organen), maar de nanodeeltjes zouden ooit kunnen worden gebruikt om de monocyten zelf te controleren.

Het kankervaccin van het Wyss Institute bootst de lymfeklieren van het lichaam na door antigenen van de tumor van een patiënt aan dendritische cellen te presenteren, die vervolgens een immuunrespons tegen kanker kunnen initiëren. Krediet:Wyss Institute aan de Harvard University
"Een van de stiekeme dingen die tumoren kunnen doen, is macrofagen uitschakelen op dezelfde manier als andere immuuncellen, zodat tot de helft van een tumor kan bestaan uit slapende macrofagen, Mitragotri legde uit. "Als we monocyten een chemisch signaal kunnen geven via een rugzak met nanodeeltjes die ze in de 'aan'-toestand houdt nadat ze zich tot macrofagen hebben gedifferentieerd, ze zouden veel effectiever kunnen zijn in het aanvallen van een tumor in plaats van er deel van uit te maken."
Een veilige ruimte creëren voor immuuncellen
Door te onderzoeken hoe het beheersen van immuuncellen kanker kan helpen doden, Mitragotri dompelt zijn tenen onder in de ontluikende beweging voor immuno-oncologie, wat de reden is dat het aanpassen van het immuunsysteem van een patiënt (dat al is ontworpen om defecte cellen op te sporen en te doden), zodat het de ontwijkende tactieken van kanker kan overwinnen, beter is dan te proberen een nieuw medicijn te ontwerpen voor elke vorm van bekende kanker. De FDA heeft de afgelopen jaren een aantal immunotherapiebenaderingen goedgekeurd, waaronder "checkpointremmer"-geneesmiddelen die de remmen van immuuncellen afremmen die zijn geïnactiveerd door kankercellen, en T-celtherapieën, waarbij de T-cellen van een patiënt worden verwijderd, hen te manipuleren om de kanker aan te vallen, ze vermenigvuldigen, en ze terug in het lichaam te infuseren.
Een nieuwere tactiek, kanker vaccins, probeert het immuunsysteem van een patiënt van binnenuit te wijzigen, zodat het niet alleen bestaande tumoren aanvalt, maar creëert ook een immuun "geheugen" om toekomstige kankergezwellen te vernietigen. Echter, het is een uitdaging gebleken om dat proces volledig in het lichaam te laten plaatsvinden. Het enige kankervaccin dat de FDA tot nu toe heeft goedgekeurd, was Provenge, in 2010. Het was een commerciële mislukking vanwege de forse $ 93, 000 prijskaartje en ingewikkeld, behandelingsproces van dagen dat meerdere infusies vereiste.
Maar één persoon was eerder geboeid dan teleurgesteld door het publieke falen van Provenge:David Mooney, een van de oprichters van de kernfaculteit van de Wyss en de Robert P. Pinkas Family Professor of Bioengineering bij SEAS. "Mijn laboratorium heeft al lang interesse in celgebaseerde therapieën voor ziekten zoals kanker. We vonden het concept om het eigen immuunsysteem van het lichaam te trainen om kanker te bestrijden echt mooi, maar we vroegen ons af of er een manier was om het te vereenvoudigen door dat hele proces in het lichaam te verplaatsen in plaats van delen ervan in een laboratorium te doen. zoals Provenge vereist."
Het lichaam heeft een natuurlijk oefenterrein in de vorm van zijn lymfeklieren, die immuuncellen herbergen, dendritische cellen genaamd, die geactiveerd worden en een immuunrespons initiëren wanneer ze bewijs detecteren van een binnendringend pathogeen uit de lymfevaten. Kankercellen, echter, afscheiden immunosuppressieve signalen die dit proces kunnen verstoren. Een materiaalwetenschapper en chemisch ingenieur van opleiding, Mooney realiseerde zich dat als hij een kunstmatige lymfeklier kon construeren en implanteren, gemaakt van een materiaal dat anders was dan de rest van het lichaam (en dus beschermd tegen de invloed van kanker), het kan een veilige haven bieden om dendritische cellen te activeren, die dan de aanval van het immuunsysteem op de kanker zou ontketenen.
Zijn lab heeft precies dat gedaan, het creëren van een kankervaccin in de vorm van een sponsachtige schijf ter grootte van een aspirinetablet die in een patiënt wordt geïmplanteerd en biologisch afbreekt zodra het zijn werk heeft gedaan. In wezen een kunstmatige lymfeklier, het vaccin bevat signalen die dendritische cellen aantrekken en activeren met eiwitten die op de tumorcellen van de patiënt worden aangetroffen. De geactiveerde dendritische cellen reizen dan naar de dichtstbijzijnde lymfeklier, waar ze andere soorten immuuncellen trainen om de tumor te herkennen en te vernietigen. This may provide the additional benefit of protecting against recurrences of the cancer—even in another location—since the trained T-cells can proliferate and circulate through the body looking for the same kind of tumor cells to attack and destroy.
Dramatic responses in cancerous mice that received the vaccine spurred Mooney and his collaborators at the Dana-Farber Cancer Institute (DFCI) to start a phase 1 clinical trial with support from both institutes, to see if it had the same effect in human patients. This kind of study is usually undertaken by hospitals and pharmaceutical companies, but rarely inside academia. In traditional pharmaceutical and biotech environments the process of getting such an innovation into clinical trials usually takes six or seven years, in this case the vaccine was tested in its first patient just three years after initial publication of its development. The results attracted the attention of the drug giant Novartis, which licensed the technology from the Wyss Institute in 2018 and took the reins for future clinical trials, with plans to develop the concept into a treatment for multiple kinds of cancer.
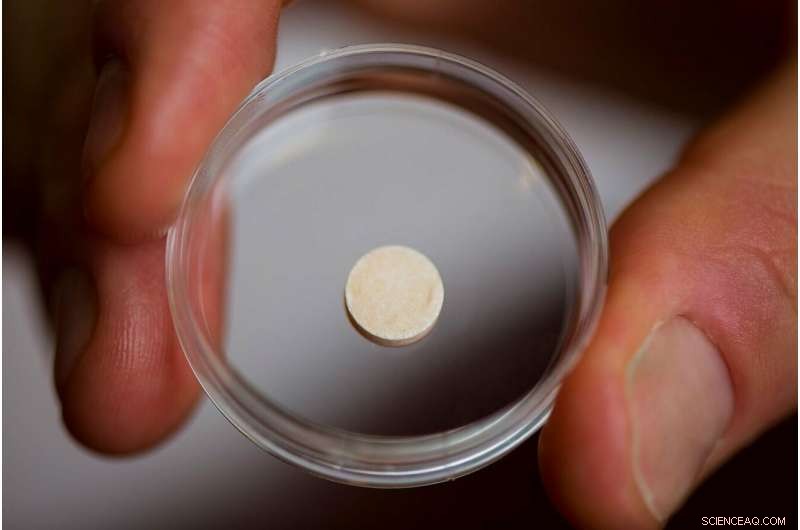
The vaccine is about the size of an aspirin tablet, and is placed inside a patient’s body using a simple incision. It also biodegrades safely, and multiple vaccines can be implanted in the same patient. Credit:Wyss Institute at Harvard University
"The Wyss Institute was just starting, and we knew we wanted to focus on translating discoveries from the lab to the clinic, " said Mooney. "So we saw the cancer vaccine not only as a treatment with real potential to help lots of patients, but also as an opportunity to create a path for moving novel therapies out of academia and into the real world faster. There is no way I could have run a clinical trial out of my laboratory, so being able to build a team inside the Wyss to do the experiments and manufacturing needed for the FDA application, and partnering with DFCI to organize and run the clinical trial, was really what allowed us to get to the point where we're implanting the vaccines in cancer patients so quickly."
One such patient, profiled in a recent Boston Globe article, remains cancer-free nearly two years after being vaccinated for advanced melanoma. But Mooney is not content to rest on his laurels. "Cancer is a complex disease, and it's unlikely there will be a single answer for all people and all kinds of cancer, so we need to keep exploring different approaches, " hij zei.
One of these approaches is a partnership with another Wyss faculty member, William Shih, who has long been interested in how his research on DNA molecules that self-assemble into defined 3-D structures—also known as DNA origami—can improve the precision with which cancer therapy is delivered. Shih and Mooney are working on a joint project to see if DNA origami–based nanostructures can be incorporated into the cancer vaccine to enhance its ability to create a sustained immune response.
"When dendritic cells are activated, either in a lymph node or in the cancer vaccine, they have a decision to make:Do they initiate an antibody response, where antibodies are produced that bind to a specific pathogen and mark [the cancer cells] for destruction, or do they initiate a T-cell response, where they send T cells to destroy the pathogen directly?" explained Shih, a professor of biological chemistry and molecular pharmacology at DFCI and Harvard Medical School (HMS). "We want to nudge them toward the T-cell response, because it's a more effective way to kill cancer cells."
Shih's DNA origami nanostructures take advantage of the fact that DNA is a very stable and predictable compound thanks to the strong bonds between its four chemical bases. By constructing strands of DNA whose sequences of bases along their length are precisely known, Shih and his lab have been able to design 3-D DNA structures that effectively build themselves like automated Lego blocks, and whose properties can be tuned down to the nanoscale.
For the cancer vaccine, Shih's lab has designed a DNA "cask" structure that presents a densely packed, precisely arranged display of ligands, or molecules that bind to other molecules, which are usually found on pathogens like bacteria or viruses and are recognized by the body's immune system as foreign. These ligands essentially produce a danger signal recognized by dendritic cells, and can make them choose to initiate a T-cell immune response more often than an antibody response. "Our initial data suggest that the precise patterning of ligands we're able to achieve with DNA origami make a big difference in activating the dendritic cells the way we want them to be activated, " Shih said. "We have this miracle [vaccine]. Let's make it better."
A Neighborhood Watch for cancer
Immunology is all the rage for treating cancers after they occur, but every cancer arises from what was once a normal cell. What if we could tease out exactly what promotes the development of cancer and find a way to reduce the chances it will form in the first place? That's a tall order, as hundreds of substances are known to cause cancer, hundreds more are suspected but unproven carcinogens, and other factors such as lifestyle and genetics all conspire to damage our DNA.
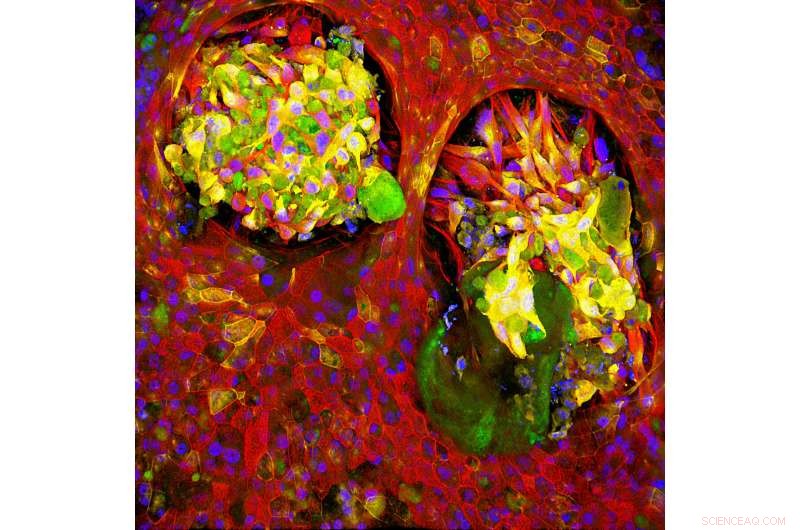
Healthy lung tissue (red) surrounds cells that express markers typically found on both cancerous and healthy cells (green and yellow) in a Lung Cancer Chip, indicating that the relationship between normal and cancerous cells is more complex than originally thought. Credit:Wyss Institute at Harvard University
But some causes play an outsized role in cancer's development, such as chronic inflammation, which is associated with nearly 25 percent of all human cancers. Research being undertaken by the Wyss Institute's founding director, Donald Ingber is now investigating the possibility of treating the inflammation of the connective tissue and blood vessels that surround and support organs (known collectively as the stroma) rather than directly attacking tumors themselves.
"Understanding how stromal tissues can influence the development of cancer has intrigued me personally since the time I was a graduate student, " said Ingber, who is also the Judah Folkman Professor of Vascular Biology at HMS and Boston Children's Hospital and a professor of bioengineering at SEAS. "We and others have shown that changes in the physical structure and composition of the stroma can promote cancer formation and, conversely, that putting cancerous cells into a healthy stromal environment can suppress tumor growth, suggesting that targeting the tumor microenvironment could lead to new cancer-reversal therapies."
Ingber is part of a global research team tackling this problem from multiple angles as part of Cancer Research UK's Grand Challenge, a competition it won earlier this year. Key to the project is Ingber's organ chip technology, which allows researchers to carry out human organ–level experimentation in vitro. Each organ chip is a microfluidic culture device containing hollow microchannels that can be lined with living human epithelial and stromal cells, which experience physical conditions similar to those found in the body, including blood flow, breathing motions in the lung, peristalsis in the intestine, and so forth. The Wyss Institute has created organ chips that faithfully mimic the lung, nier, intestine, bone marrow, brain, and more, allowing researchers to grow tumor cells within the natural microenvironments found in the body and then test treatments without exposing animals or patients to potentially harmful conditions.
"Our organ chips have shown us time and time again that in order for organ cells to function normally, they have to be provided with the right microenvironment, " said Ingber. "For this project, we will build models of different stages of cancer progression using cells isolated from human patients to understand how interactions between stromal cells and organ-lining cells change as inflammation-associated cancers form, as well as develop new ways to combat this response."
By combining organ chips with bioinformatics and machine-learning approaches, the team hopes to identify new stromal-targeted treatments that can restore inflamed tissue to its healthy form, thereby preventing cancer progression, or induce cancerous or precancerous tissues to revert to a more normal state. By studying human cancer progression in vitro, the team also hopes to discover new diagnostics that can be used to identify the small subset of patients with inflammation-associated premalignant conditions, such as Barrett's esophagus or ulcerative colitis, that might progress to cancer.
"Treating cancer is ultimately going to need to be a multifaceted approach, because the disease itself is so multifaceted, " Ingber said. "The Wyss Institute was founded on the basis of bringing people together from different disciplines to tackle big problems in medicine through communication and collaboration among experts with a broad range of different perspectives. Doing that within the Wyss Institute has led to advances like organ chips, and doing that at a larger scale, such as with the Grand Challenge, allows whole institutions to put their resources together and drive real change for millions of patients living with devastating diseases like cancer worldwide."
Whether targeting blood cells, het immuunsysteem, or stromal tissue, all of these projects are guided by the principle of using existing biological elements as the basis for new therapies, rather than trying to invent new cures from scratch.
"The human body is a marvel of biological engineering that has been tuned over millions of years to be able to fight off threats and heal itself, " said Ingber. "When we can recognize its inherent abilities and work with them rather than against them, we are taking full advantage of all the experimentation that evolution has already done for us. We believe this type of interdisciplinary, bio-inspired approach can help create more new treatments for cancer and other complicated diseases much more effectively than traditional drug development strategies."
Dit verhaal is gepubliceerd met dank aan de Harvard Gazette, Harvard University's official newspaper. Voor aanvullend universiteitsnieuws, bezoek Harvard.edu.
 Snelste zeer nauwkeurige 3D-printer
Snelste zeer nauwkeurige 3D-printer Onderzoeksteam toont complexe, 3D-geprinte schwarzieten zijn bestand tegen druk wanneer ze zijn gecoat
Onderzoeksteam toont complexe, 3D-geprinte schwarzieten zijn bestand tegen druk wanneer ze zijn gecoat Een antibioticum dat zich voordoet als een natuurlijke verbinding in de gigantische Madeiraanse squill
Een antibioticum dat zich voordoet als een natuurlijke verbinding in de gigantische Madeiraanse squill Nieuwe coating brengt lithium-metaalbatterij dichter bij de realiteit
Nieuwe coating brengt lithium-metaalbatterij dichter bij de realiteit Om aminozuren te maken, voeg gewoon elektriciteit toe
Om aminozuren te maken, voeg gewoon elektriciteit toe
Hoofdlijnen
- Fysische structuur van chromosomen
- Hoe is de katoenplant aangepast om te overleven?
- Unicorn Root herleeft zichzelf na 130 jaar
- Welke bijdrage heeft Avery geleverd aan de ontdekking van DNA?
- Hoe maak je een plantencelmodel op stap-voor-stap
- Vogelgriep:Nederlandse boeren moeten pluimvee binnen houden
- Hoe verslaving werkt
- Artefacten suggereren aankomst van mensen in Australië 18,
- Factoren die betrokken zijn bij celdifferentiatie
- Transparante zonnecellen voor ramen die elektriciteit opwekken

- Brandalarmbehang detecteert, weerstaat, en waarschuwt voor huisbranden

- 3D-printen van biologisch weefsel

- DNA als onzichtbare inkt kan patronen omkeerbaar verbergen
- Nieuw materiaal gesynthetiseerd:grafeen nanoribbons binnenkant van koolstof nanobuisjes

 Hoe een ruimteschip te besturen?
Hoe een ruimteschip te besturen?  Op maat gemaakte koolstof kan wetenschappers helpen bij het vinden van erfelijke ziekten en de juiste doses medicatie
Op maat gemaakte koolstof kan wetenschappers helpen bij het vinden van erfelijke ziekten en de juiste doses medicatie De effecten van zonnevlammen op technologie
De effecten van zonnevlammen op technologie Nieuw kader zal helpen beslissen welke bomen het beste zijn in de strijd tegen luchtvervuiling
Nieuw kader zal helpen beslissen welke bomen het beste zijn in de strijd tegen luchtvervuiling Tariefproblemen oplossen
Tariefproblemen oplossen Nieuw-Zeeland waarschuwt Google voor naam moordverdachte
Nieuw-Zeeland waarschuwt Google voor naam moordverdachte Op drones gebaseerde fotogrammetrie een nieuwe toevoeging aan geologische onderzoeksdiensten
Op drones gebaseerde fotogrammetrie een nieuwe toevoeging aan geologische onderzoeksdiensten Hoe het gewicht te berekenen met behulp van Density & Volume
Hoe het gewicht te berekenen met behulp van Density & Volume
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Swedish | German | Dutch | Danish | Portuguese | Norway |

-
Wetenschap © https://nl.scienceaq.com

