
Wetenschap
Krachtige microscoop legt eerste beeld vast van nanoscaffold dat celbeweging bevordert
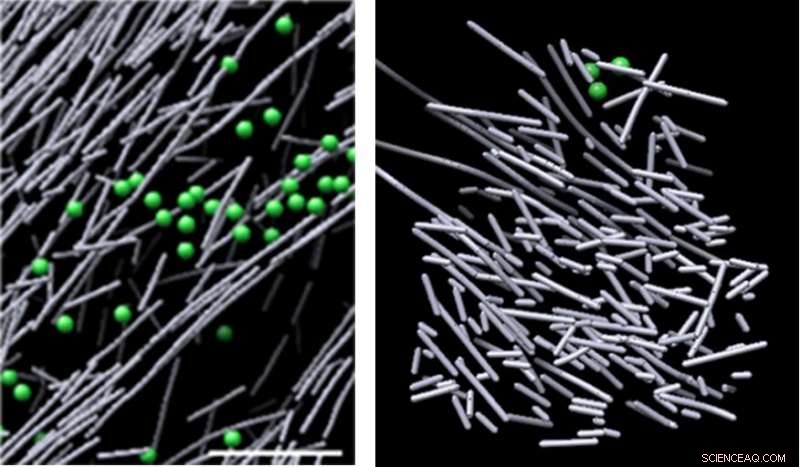
Cryo-elektronenmicroscoopbeelden van actine-assemblage in de cel bij afwezigheid van een moleculair signaal (links) en de hooibergachtige actinefilament nanoscaffold die werd geïnduceerd als reactie op een moleculair signaal (Rac1) en celbeweging bevordert (rechts). De structuur kwam in beeld in gedefinieerde regio's waar Rac1 was geactiveerd, en verdween snel toen de Rac1-signalering stopte - in slechts twee en een halve minuut. Krediet:Sanford Burnham Prebys Medical Discovery Institute (SBP)
Er zijn veel momenten waarop onze cellen moeten bewegen. Mobiele cellen sturen de vorming van ons lichaam (embryonale ontwikkeling). Immuuncellen zwerven rond om ongewenste indringers te vangen. En genezende cellen (fibroblasten) migreren om wonden te herstellen. Maar niet alle beweging is wenselijk:tumoren zijn het gevaarlijkst wanneer kankercellen het vermogen krijgen om door het lichaam te reizen (metastase). Bepaalde bacteriën en virussen kunnen de beweeglijkheid van de cellen gebruiken om ons lichaam binnen te dringen. Begrijpen hoe cellen bewegen - en de staafachtige actinefilamenten die het proces aansturen - is de sleutel tot het leren stoppen of bevorderen van de beweeglijkheid om de menselijke gezondheid te verbeteren.
Nutsvoorzieningen, met behulp van een van de krachtigste microscopen ter wereld, wetenschappers van het Sanford Burnham Prebys Medical Discovery Institute (SBP) en de University of North Carolina in Chapel Hill (UNC-Chapel Hill) hebben een dichte, dynamische en ongeorganiseerde actinefilament nanoscaffold - die lijkt op een hooiberg - die wordt geïnduceerd als reactie op een moleculair signaal. Dit is de eerste keer dat onderzoekers direct hebben gevisualiseerd, op moleculair niveau, een structuur die wordt geactiveerd als reactie op een cellulair signaal - een belangrijke bevinding die ons begrip van hoe cellen bewegen uitbreidt. De studie werd gepubliceerd in de Proceedings van de National Academy of Sciences van de Verenigde Staten van Amerika ( PNAS ).
"Cyro-elektronenmicroscopie zorgt voor een revolutie in ons begrip van de innerlijke werking van cellen, " zegt Dorit Hanein, doctoraat, senior auteur van de paper en professor in het Bioinformatics and Structural Biology Program bij SBP. "Deze technologie stelde ons in staat om robuuste, 3D-beelden van celgebieden - vergelijkbaar met MRI, die gedetailleerde beelden van ons lichaam creëert. We waren in staat om cellen in hun natuurlijke staat te visualiseren, die een nooit eerder vertoonde actine-nano-architectuur in de cel onthulde."
In de studie, de wetenschappers gebruikten de cryo-elektronenmicroscoop van SBP (Titan Krios), kunstmatige intelligentie (AI) en op maat gemaakte computationele en celbeeldvormingsbenaderingen om nanoschaalbeelden van muisfibroblasten te vergelijken met tijdgestempelde lichtbeelden van fluorescerend Rac1, een eiwit dat de celbeweging reguleert, reactie op kracht of spanning (mechanosensing) en invasie van pathogenen. Deze technisch complexe workflow - die vijf ordes van grootte overbrugde (tientallen microns tot nanometers) - kostte jaren om zich te ontwikkelen tot het huidige niveau van robuustheid en nauwkeurigheid en werd mogelijk gemaakt door experimentele en computationele inspanningen van de structurele biologenteams bij SBP en het biosensorenteam van UNC-Chapel Hill.
De beelden onthulden een dicht opeengepakte, ongeorganiseerd, steigerachtige structuur bestaande uit korte actinestaven. Deze structuren kwamen in beeld in gedefinieerde regio's waar Rac1 werd geactiveerd, en verdween snel toen de Rac1-signalering stopte - in slechts twee en een halve minuut. Deze dynamische scaffold stond in schril contrast met verschillende andere actine-assemblages in gebieden met lage Rac1-activering - sommige bestaan uit lange, uitgelijnde staven van actine, en andere bestaan uit korte actinestaven die vertakken vanaf de zijkanten van langere actinefilamenten. Het volume dat de actine-steiger omhult, was verstoken van gemeenschappelijke cellulaire structuren, zoals ribosomen, microtubuli, blaasjes en meer, waarschijnlijk vanwege de intense dichtheid van de structuur.
"We waren verrast dat experiment na experiment deze unieke hotspots van niet-uitgelijnde, dicht opeengepakte actinestaven in regio's die correleerden met Rac1-activering, " zegt Niels Volkmann, doctoraat, een co-corresponderende auteur van het artikel die het computationele deel van het onderzoek leidde, en professor in het Bioinformatics and Structural Biology Program bij SBP. "Wij geloven dat deze aandoening eigenlijk de kracht van de steiger is - het geeft de flexibiliteit en veelzijdigheid om grotere, complexe actinefilamentarchitecturen als reactie op aanvullende lokale ruimtelijke aanwijzingen."
Volgende, de wetenschappers willen het protocol uitbreiden om meer structuren te visualiseren die worden gecreëerd als reactie op andere moleculaire signalen en om de technologie verder te ontwikkelen om toegang tot andere delen van de cel mogelijk te maken.
"Deze studie is slechts het begin. Nu we deze kwantitatieve workflow op nanoschaal hebben ontwikkeld die dynamisch signaleringsgedrag correleert met de resolutie op nanoschaal van elektronencryotomografie, wij en andere wetenschappers kunnen dit krachtige analytische hulpmiddel niet alleen implementeren voor het ontcijferen van de innerlijke werking van celbewegingen, maar ook voor het ophelderen van de dynamiek van vele andere macromoleculaire machines in een onverstoorde cellulaire omgeving, ’ zegt Hanine.
Zij voegt toe, "Actine is een bouwsteeneiwit; het interageert met meer dan 150 actinebindende eiwitten om diverse structuren te genereren, elk met een unieke functie. We hebben een overschot aan verschillende signalen die we in kaart willen brengen, wat nog meer inzicht zou kunnen geven in hoe cellen bewegen."
 Satellieten waarschuwen voor sprinkhanenplagen
Satellieten waarschuwen voor sprinkhanenplagen Klimaatverandering:obsessie met plasticvervuiling leidt de aandacht af van grotere milieu-uitdagingen
Klimaatverandering:obsessie met plasticvervuiling leidt de aandacht af van grotere milieu-uitdagingen Amerikaanse staten starten juridische stappen tegen energievertraging Trump
Amerikaanse staten starten juridische stappen tegen energievertraging Trump Hoe het verschil te zien tussen giftige en niet-giftige spinnen
Hoe het verschil te zien tussen giftige en niet-giftige spinnen Onderzoekers ontdekken dat wegen het aardoppervlak verbrijzelen in 600, 000 fragmenten
Onderzoekers ontdekken dat wegen het aardoppervlak verbrijzelen in 600, 000 fragmenten
Hoofdlijnen
- Tropische kevers worden met uitsterven bedreigd
- Twee studies vinden dat stress cellen herprogrammeert
- Evolutie:de begunstigden van massale uitsterving
- Veldonderzoek heeft tot doel de verspreiding van door teken overgedragen ziekten in het Midwesten te vertragen
- Virusstamping - een veelzijdige nieuwe methode voor genetische manipulatie van afzonderlijke cellen
- Satellietvolging geeft aanwijzingen over verloren jaren aan Zuid-Atlantische zeeschildpadden
- Chimpansees en roetzwarte mangabeys verstoren de relaties van andere groepsleden
- Onderzoekers beschrijven allereerste hybride vogelsoorten uit de Amazone
- Linnaean-classificatie: definitie, niveaus en voorbeelden (met grafiek)
- Nano-inkapselingstechnologie verbetert de DHA-absorptie voor vroege hersenontwikkeling

- Biomedische doorbraak:koolstofnanodeeltjes die je thuis kunt maken

- Nanowetenschappers ontwikkelen de ultieme ontdekkingstool
- De sterkte van bacteriële hechting is niet afhankelijk van de grootte van het contactoppervlak

- Stressverlagend substraat helpt OLED tweedimensionaal uit te rekken

 Lijst met eencellige organismen
Lijst met eencellige organismen  De levenscyclus van Selaginella
De levenscyclus van Selaginella Zoutmanden op nanoschaal van dichtbij (met video)
Zoutmanden op nanoschaal van dichtbij (met video) Leiders opgeleid in economie stimuleren snellere economische groei, studie vondsten
Leiders opgeleid in economie stimuleren snellere economische groei, studie vondsten Hubble-gegevens bevestigen sterrenstelsels zonder donkere materie
Hubble-gegevens bevestigen sterrenstelsels zonder donkere materie Lied uit het verre verleden, een nieuwe fossiele fazant uit China behoudt een superlange luchtpijp
Lied uit het verre verleden, een nieuwe fossiele fazant uit China behoudt een superlange luchtpijp Imec demonstreert optische modulator van breedband grafeen op silicium
Imec demonstreert optische modulator van breedband grafeen op silicium Diffuse röntgenstraling gedetecteerd rond de ultralichtgevende röntgenpulsar NGC 5907 ULX-1
Diffuse röntgenstraling gedetecteerd rond de ultralichtgevende röntgenpulsar NGC 5907 ULX-1
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Spanish | Portuguese | German | Dutch | Danish | Norway | Italian | Swedish |

-
Wetenschap © https://nl.scienceaq.com

