
Wetenschap
De sterkte van bacteriële hechting is niet afhankelijk van de grootte van het contactoppervlak
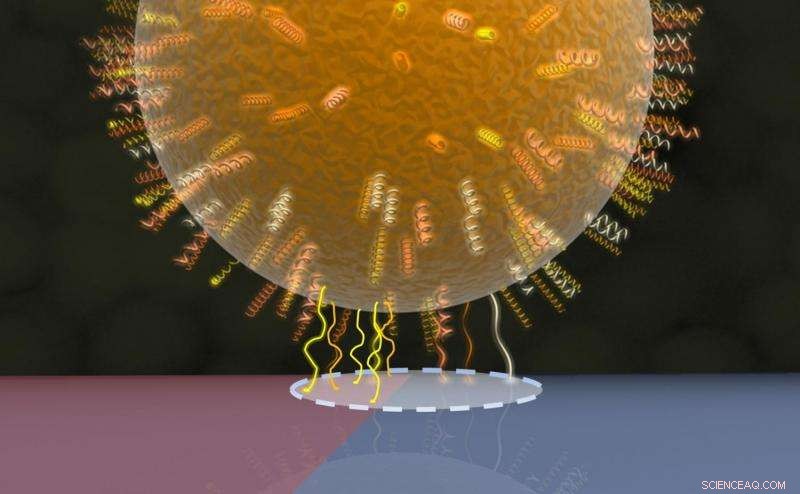
Model van het bacteriële contactgebied:celwandeiwitten in een cirkelvormig gebied (stippellijn) maken contact met het onderliggende oppervlak, waarvan de ene helft in rood is weergegeven (hydrofoob gebied met meer eiwitcontacten) en de andere helft in blauw (hydrofiel gebied met minder eiwitcontacten). Krediet:AG Jacobs
Een team van natuurkundigen en biologen van de Universiteit van Saarland heeft een methode ontwikkeld waarmee ze het contactoppervlak kunnen meten tussen een bacterie en het oppervlak waarop hij 'zit'. interessant, en misschien contra-intuïtief, een groot contactoppervlak betekent niet noodzakelijk een grote houdkracht. Het blijkt dat specifieke kenmerken van de bacteriën, waardoor lokale verschillen in de samenstelling van de eiwitten in de celwand ontstaan, zijn de belangrijkste redenen voor de waargenomen verschillen in hechting. Deze resultaten kunnen nu worden gebruikt om antibacteriële materialen te optimaliseren. Het onderzoekswerk wordt vandaag gepubliceerd in het tijdschrift nanoschaal .
Bacteriën van de soort Staphylococcus aureus behoren tot de meest voorkomende en gevaarlijke pathogenen van onze tijd. Een van de redenen voor hun effectiviteit is hun vermogen om te hechten aan zowel synthetische als natuurlijke oppervlakken, waar ze zeer persistente biofilms vormen. Deze biofilms beschermen de afzonderlijke ziekteverwekkers effectief, waardoor ze zeer moeilijk van een oppervlak te verwijderen zijn. Dit is de reden waarom hun aanwezigheid op medische implantaten zo gevreesd is en waarom ze een belangrijke oorzaak zijn van postoperatieve infecties. Een benadering om infectie te voorkomen is daarom het voorkomen van de vorming van de biofilm. Maar om biofilmgroei te kunnen beïnvloeden, wetenschappers moeten het mechanisme begrijpen waarmee de bacteriën zich aan oppervlakken hechten. Bijvoorbeeld, het zou nuttig zijn om te weten welk deel van het oppervlak van een enkele bacteriecel daadwerkelijk in contact is met het oppervlak. Echter, aangezien deze bolvormige bacteriën slechts een micrometer breed zijn (ongeveer een honderdste van de dikte van een mensenhaar), het was onwaarschijnlijk dat conventionele lichtmicroscopie zou kunnen worden gebruikt om het contactgebied te bepalen.
Het team van de Universiteit van Saarland onder leiding van de experimenteel natuurkundige professor Karin Jacobs en de microbioloog professor Markus Bischoff maakte daarom gebruik van een andere eigenschap van de bacterie, namelijk dat de hechtsterkte van verschillende soorten bacteriën vaak sterk afhangt van het type oppervlak waarop het zich bevindt. Bijvoorbeeld, de bacteriën die de focus van de huidige studie waren, hechten veel effectiever aan sterk hydrofobe oppervlakken dan aan bevochtigbare (hydrofiele) oppervlakken. De onderzoekers creëerden daarom een op silicium gebaseerd oppervlak dat beide eigenschappen vertoonde - sterk hydrofoob in één regio, zeer bevochtigbaar in een ander - binnen een extreem klein gebied. De kleefkracht die door individuele bacteriën op dit speciaal geprepareerde oppervlak wordt uitgeoefend, werd vervolgens gemeten met behulp van een scanning atomic force-microscoop, bekend als een krachtspectroscoop.
De methode houdt in dat een enkele bacteriecel minimaal in contact komt met het oppervlak en vervolgens de kracht wordt gemeten die nodig is om de bacterie van dat oppervlak los te maken. Dit is de houdkracht. Op het hydrofobe (letterlijk 'waterhatende') deel van het oppervlak, de kracht is ongeveer tien keer groter dan die nodig is wanneer de bacteriecel zich hecht aan het hydrofiele ('waterminnende') gebied. Deze procedure wordt vervolgens herhaald waarbij de bacteriecel zich achtereenvolgens dichter bij de grens tussen de hydrofobe en hydrofiele regio's bevindt, vervolgens de kracht meten met de bacterie die zich op de grens zelf bevindt en tenslotte met de bacterie die zich in de zuiver hydrofiele zone bevindt waar de houdkracht het zwakst is. De meetgegevens die de houdkracht van een enkele cel relateren aan de exacte positie op het speciaal aangepaste oppervlak, en daarmee de bevochtigbaarheid van het oppervlak, heeft het onderzoeksteam van Saarbrücken in staat gesteld om de grootte van het contactgebied tussen de bacterie en het oppervlak af te leiden. De methode kan ook worden gebruikt voor andere metingen, zoals het bepalen van de houdkracht van colloïdale deeltjes, die ook bolvormig zijn.
Het onderzoeksteam ontdekte dat de diameter van het contactgebied, waarvan werd aangenomen dat het cirkelvormig was, in de orde van enkele tientallen tot enkele honderden nanometers (duizend nanometers is gelijk aan een duizendste van een millimeter) en dat de grootte van het contactoppervlak aanzienlijk kan variëren tussen verschillende individuele cellen van dezelfde soort Staphylococcus aureus. Ter vergelijking, er werd ook een niet-pathogeen lid van het geslacht Staphylococcus bestudeerd dat veel minder sterk aan het oppervlak hecht dan het pathogeen Staphylococcus aureus. Het is bijzonder verbazingwekkend dat de grootte van het contactoppervlak absoluut geen invloed heeft op de hechtingskracht tussen een bacteriecel en het oppervlak. De onderzoekers konden ook aantonen dat ondanks hun bolvorm, de bacteriën kunnen niet eenvoudig worden beschreven als harde bollen wanneer ze een interactie aangaan met een oppervlak. Een meer accurate beschrijving is om ze te zien als ballen die bedekt zijn met een zachte, ruige en ongelijkmatige coating van celwandeiwitten en dat deze vacht de belangrijkste factor is die de hechting tussen de cel en het oppervlak bepaalt. De uitgesproken lokale variabiliteit in de adhesiekracht weerspiegelt de verschillende samenstellingen van de groepen celwandeiwitten, die bepalen hoe sterk een gebied van het celoppervlak aan een oppervlak kan hechten.
De benadering die in het onderzoek wordt gebruikt, kan in principe, worden toegepast op alle andere soorten bacteriële pathogenen, ongeacht of ze bolvormig of staafvormig zijn. De resultaten kunnen de weg vrijmaken voor het ontwikkelen van oppervlakken waarvan de morfologie zorgvuldig kan worden aangepast om deze adhesiekrachten te wijzigen, waardoor de adhesie van ongewenste bacteriële pathogenen wordt onderdrukt, of, alternatief, bevordering van de aanhechting van bacteriën, zoals die worden gebruikt voor afvalverwerking, wiens aanwezigheid gewenst is.
 Kunstmatige spieren aangedreven door glucose
Kunstmatige spieren aangedreven door glucose Koraalvormige nanodeeltjes gebouwd door ontwerp met behulp van gemanipuleerde peptoïden
Koraalvormige nanodeeltjes gebouwd door ontwerp met behulp van gemanipuleerde peptoïden Hybride materiaal kan in verschillende toepassingen beter presteren dan grafeen
Hybride materiaal kan in verschillende toepassingen beter presteren dan grafeen Wetenschappers onderzoeken macrocyclische peptiden als nieuwe medicijnsjablonen
Wetenschappers onderzoeken macrocyclische peptiden als nieuwe medicijnsjablonen Nieuwe technologie voor de levering van geneesmiddelen tegen kanker op aanvraag
Nieuwe technologie voor de levering van geneesmiddelen tegen kanker op aanvraag
 Negatieve effecten van Biomass
Negatieve effecten van Biomass Onmogelijk om aan te passen:Verrassend snel smelten van ijs in het verleden verhoogt de angst voor zeespiegelstijging
Onmogelijk om aan te passen:Verrassend snel smelten van ijs in het verleden verhoogt de angst voor zeespiegelstijging De geschiedenis van riviersediment suggereert dat het klimaatverandering was, geen Mongoolse invasie die Transoxanië heeft verdoemd
De geschiedenis van riviersediment suggereert dat het klimaatverandering was, geen Mongoolse invasie die Transoxanië heeft verdoemd Is een gekoelde voedselketen een netto winst of verlies voor klimaatemissies?
Is een gekoelde voedselketen een netto winst of verlies voor klimaatemissies? Visteelthouderij
Visteelthouderij
Hoofdlijnen
- Maakt Thanksgiving Turkije je echt slaperig?
Als je Thanksgiving-ritueel gepaard gaat met flauwvallen op de bank na een maaltijd, weet je al dat een feest met alles erop en eraan je moe maakt. Maar ondertekende de kalkoen je enkeltje naar snoozevil
- Hoe bacteriën worden gereproduceerd?
- Wat zijn de vier fasen van volledige glucose-afbraak?
- Wetenschapsprojecten: roken en de effecten ervan op de longen
- Inzicht in onze levensduur van meer dan 50 jaar die nog steeds in ontwikkeling is, genetische studie toont aan
- Waarom maken we verkeerde keuzes?
- Hoe u uw hersenen kunt stimuleren
- Nieuwe vogelsoort genoemd naar Harvard-vader van biodiversiteit
- Waarom zou een cel veel rRNA maken, maar slechts één exemplaar van DNA?
- Een 3D-collageenmodel ontwikkelen om magnetisch geassisteerde osteogenese in vitro te testen

- Bacteriën versnipperen technologie om resistente superbacteriën te bestrijden

- Onderzoekers ontwikkelen geïntegreerde nanomechanische sensor voor atoomkrachtmicroscopie

- Nieuwe technologie vermindert het energieverbruik van MRAM- en AI-hardware
- Nanobuisjes nesten om 1-D van der Waals heterostructuren te maken

 Lyft verliest weer geld, maar ziet winst in ongeveer 2 jaar
Lyft verliest weer geld, maar ziet winst in ongeveer 2 jaar Storing treft Facebook-services wereldwijd
Storing treft Facebook-services wereldwijd Enorme zonne- en windparken kunnen vegetatie terugbrengen naar de Sahara
Enorme zonne- en windparken kunnen vegetatie terugbrengen naar de Sahara Wat is zonnepeil?
Wat is zonnepeil?  Hoe te handelen Dosering van medicijnen
Hoe te handelen Dosering van medicijnen Een nieuwe cycloon doemt op voor India, week na dodelijke storm
Een nieuwe cycloon doemt op voor India, week na dodelijke storm Hoe microgrammen naar micromollen converteren
Hoe microgrammen naar micromollen converteren De natuur benutten om het toenemende overstromingsrisico te beheersen
De natuur benutten om het toenemende overstromingsrisico te beheersen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Portuguese | Swedish | German | Dutch | Danish | Norway | Spanish |

-
Wetenschap © https://nl.scienceaq.com

