
Wetenschap
Wetenschappers laten zien hoe zout de reactietemperaturen verlaagt om nieuwe materialen te maken
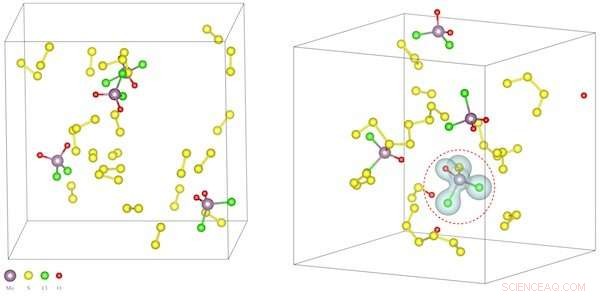
Wetenschappers van Rice University bouwden computermodellen van intermediaire reacties om te begrijpen waarom zout de reactietemperaturen verlaagt bij de synthese van tweedimensionale verbindingen. Linksboven, molybdeenoxychloride-precursormoleculen ondergaan sulfatering waarbij zwavelatomen zuurstofatomen vervangen. Dat zorgt ervoor dat het materiaal nieuwe verbindingen vormt. Rechts, de berekeningen tonen de ladingsdichtheden van de nieuwe moleculen. Krediet:Yakobson Group
Een snufje zout kan het maken van tweedimensionale materialen vereenvoudigen, en dankzij wetenschappers van Rice University, de reden wordt duidelijk.
Boris Yakobson, een Rice hoogleraar materiaalkunde en nano-engineering en scheikunde, was de go-to-expert toen een groep laboratoria in Singapore, China, Japan en Taiwan gebruikten zout om een "bibliotheek" te maken van 2D-materialen die overgangsmetalen en chalcogenen combineerden.
Deze verbindingen kunnen leiden tot kleinere en snellere transistors, fotovoltaïsche, sensoren en katalysatoren, volgens de onderzoekers.
Door eerste-principe moleculaire dynamica-simulaties en nauwkeurige energieberekeningen, Yakobson en zijn collega's hebben vastgesteld dat zout de temperatuur verlaagt waarbij sommige elementen in een chemische dampafzetting (CVD)-oven interageren. Dat maakt het gemakkelijker om atoomdikke lagen te vormen, vergelijkbaar met grafeen, maar met het potentieel om hun chemische samenstelling aan te passen voor specifiek laagmateriaal en dienovereenkomstig elektrisch, optisch, katalytische en andere nuttige eigenschappen.
Het onderzoeksteam, waaronder Yakobson en Rice, postdoctoraal onderzoeker Yu Xie en afgestudeerde student Jincheng Lei, rapporteerde deze week zijn resultaten in Natuur .
Het team onder leiding van Zheng Liu van de Nanyang Technological University in Singapore gebruikte zijn doorgewinterde techniek met CVD om 47 verbindingen van metaalchalcogeniden te maken (die een chalcogen en een elektropositief metaal bevatten). De meeste nieuwe verbindingen hadden twee ingrediënten, maar sommige waren legeringen van drie, vier en zelfs vijf. Veel van de materialen waren bedacht en zelfs begeerd, Yakobson zei, maar nooit gemaakt.
In het CVD-proces, atomen geëxciteerd door temperaturen - in dit geval tussen 600 en 850 graden Celsius (1, 112 en 1, 562 graden Fahrenheit) - een gas vormen en uiteindelijk neerslaan op een substraat, koppelen aan atomen van complementaire chemie om monolaagkristallen te vormen.
Onderzoekers vermoedden al dat zout het proces zou kunnen vergemakkelijken, zei Yakobson. Liu kwam naar hem toe om een moleculaire modelanalyse te vragen om erachter te komen waarom zout het gemakkelijker maakte om metalen met chalcogenen te smelten en ze te laten reageren. Dat zou hen helpen te leren of het zou kunnen werken binnen het bredere palet van het periodiek systeem.
"Ze hebben indrukwekkend veel werk verzet om veel nieuwe materialen te maken en ze allemaal uitgebreid te karakteriseren, " zei Yakobson. "Vanuit ons theoretisch perspectief, de nieuwigheid in deze studie is dat we nu beter begrijpen waarom het toevoegen van gewoon zout het smeltpunt van deze metaaloxiden verlaagt en vooral de energiebarrières van de tussenproducten vermindert op weg naar de transformatie ervan in chalcogeniden."
Of het nu gaat om gewoon keukenzout (natriumchloride) of meer exotische verbindingen zoals kaliumjodide, zout bleek chemische reacties mogelijk te maken door de energetische barrière te verlagen die anders voorkomt dat moleculen interactie aangaan bij iets minder dan ultrahoge temperaturen, zei Yakobson.
"Ik noem het een 'zoutaanval', ', zei hij. 'Dit is belangrijk voor de synthese. Eerst, als je vaste deeltjes probeert te combineren, hoe klein ze ook zijn, ze hebben nog beperkt contact met elkaar. Maar als je ze smelt, met de hulp van zout, je krijgt veel contact op moleculair niveau.
"Tweede, zout vermindert het sublimatiepunt, waarbij een vaste stof een fasetransformatie naar gas ondergaat. Het betekent dat meer van de samenstellende moleculen van het materiaal in de gasfase springen. Dat is goed voor algemene transport- en contactproblemen en helpt de algehele reactie."
Het Rice-team ontdekte dat het proces de vorming van het 2-D-materiaal zelf niet zo veel vergemakkelijkt, als wel de vorming van intermediaire oxychloriden. Deze oxychloriden leiden vervolgens tot de 2-D chalcogenidegroei.
Het detailleren van dit proces vereiste intensieve atoom-voor-atoom simulaties, zei Yakobson. Dit vergde weken van zware berekeningen van de kwantuminteracties tussen slechts ongeveer 100 atomen - allemaal om slechts 10 picoseconden van een reactie te tonen. "We only did four of the compounds because they were so computationally expensive, and the emerging picture was clear enough, ' zei Yakobson.
 Duitsland wil EU-voorzitterschap klimaatneutraal maken
Duitsland wil EU-voorzitterschap klimaatneutraal maken Amerikaanse voorspellers:verwacht bijna normaal Atlantisch orkaanseizoen
Amerikaanse voorspellers:verwacht bijna normaal Atlantisch orkaanseizoen De milieuscorekaart van Australië uit 2017:hoge temperaturen zorgen voor nog meer stress voor ecosystemen
De milieuscorekaart van Australië uit 2017:hoge temperaturen zorgen voor nog meer stress voor ecosystemen Cycloon treft India, Bangladesh; 6 doden, 1.1M geëvacueerd
Cycloon treft India, Bangladesh; 6 doden, 1.1M geëvacueerd Lijst van eetbare waterplanten
Lijst van eetbare waterplanten
Hoofdlijnen
- Wat is de basis voor uitzonderingen op het Aufbau-principe?
- Wetenschappers ontwikkelen nieuwe aanpak om belangrijke onontdekte functies van eiwitten te identificeren
- Nieuwe interactieve technologie maakt zeldzame celtypes zichtbaar
- Het vinden van een dodelijke parasieten kwetsbaarheden
- P53 (TP53) Tumor Protein: Function, Mutation
- Nieuwe insectensoort bootst dode bladeren na voor camouflage
- Welke organel moet aanwezig zijn in grote aantallen in spiercellen?
- Hoe reproduceren protisten?
- Het simuleren van seks met walvisachtigen met kadaverdelen biedt inzicht in mariene copulatie
- Venus-flytrap-achtige grijper zou individuele cellen in het menselijk lichaam kunnen vangen
- Borstkanker blootleggen met polymeren op nanoschaal

- Bacteriële magnetische nanodeeltjes voor biomedische toepassingen
- De chaos in lichtbronnen onder controle brengen

- Verkeer regelen op de elektronensnelweg - onderzoek naar grafeen

 Synthetische chemie haalt antikankerverbindingen uit de zeeslak en het laboratorium in
Synthetische chemie haalt antikankerverbindingen uit de zeeslak en het laboratorium in PoortHuis, Gannett fuseert voor 1,4 miljard dollar bouw krantengigant
PoortHuis, Gannett fuseert voor 1,4 miljard dollar bouw krantengigant Oude oorsprong van allosterische activering in de oudste kinasen
Oude oorsprong van allosterische activering in de oudste kinasen Koeweit gaat tegen 2040 $ 500 miljard uitgeven aan olieprojecten
Koeweit gaat tegen 2040 $ 500 miljard uitgeven aan olieprojecten Hoe gyroscopen werken
Hoe gyroscopen werken  Een kubuswortel in een grafische rekenmachine plaatsen
Een kubuswortel in een grafische rekenmachine plaatsen Hoe mangroven mensen beschermen tegen steeds frequentere en krachtigere tropische stormen
Hoe mangroven mensen beschermen tegen steeds frequentere en krachtigere tropische stormen Wat zijn de verschillen tussen katten- en vogelfdrukken in sneeuw?
Wat zijn de verschillen tussen katten- en vogelfdrukken in sneeuw?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

