Wetenschap
Thermo-getriggerde afgifte van een genoombewerkingsmachine door gemodificeerde gouden nanodeeltjes voor tumortherapie
Krediet:Wiley
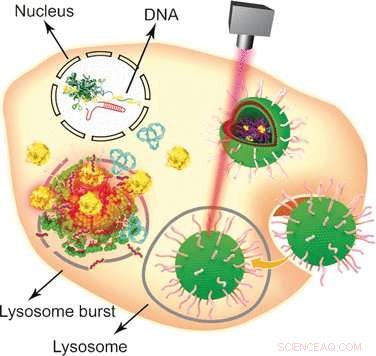
Genbewerking is een van de meest besproken onderwerpen in kankeronderzoek. Een Chinees onderzoeksteam heeft nu een op goud-nanodeeltjes gebaseerd multifunctioneel voertuig ontwikkeld om de "genenschaar" naar het tumorcelgenoom te transporteren. Zoals de auteurs in het tijdschrift rapporteren Angewandte Chemie , hun niet-virale transport- en afgifteplatform van genbewerkingssystemen heeft het extra voordeel dat het hyperthermische kankertherapie combineert met genetische modificatie.
Sinds de ontdekking in 2002, de bacteriële antivirale verdedigingsstrategie CRISPR-Cas9 is naar voren gekomen als een van de meest populaire benaderingen van genoomengineering met brede toepassingen op het gebied van moleculaire biologie en medische biologie. Met behulp van het CRISPR-Cas9-systeem, een doelgen kan worden bewerkt, uitgeteld, of ingebracht in eukaryote cellen op een relatief eenvoudige en gemakkelijke manier. Echter, een van de zwakke punten is de enorme omvang, die het gebruik van specifieke niet-virale vehikels vereist om het grote plasmide aan de kern af te leveren. Combinatie van gevestigde lipideformuleringen met gouden nanodeeltjes, Wenfu Zheng en zijn collega's van het National Center for NanoScience and Technology, Peking, China, in samenwerking met medische wetenschappers in Japan en China, hebben een multifunctioneel hulpmiddel gevonden en getest op basis van eenvoudige componenten die het CRISPR-Cas9-systeem effectief in tumoren aflevert en vrijgeeft. Laserbestraling werd gebruikt om het lipide-nanogold-voertuig na binnenkomst in de tumorcellen te demonteren en de CRISPR-Cas9-genbewerking mogelijk te maken. De knock-out van het beoogde gen leidde vervolgens tot apoptose en remming van de tumorgroei.
Gouden nanodeeltjes zijn bijzonder aantrekkelijke dragers voor verschillende biologische moleculen vanwege hun gemakkelijke modificatie, stabiliteit, en licht-bestralingsreactie. Om ze om te bouwen tot een veelzijdig biologisch transport- en bezorgvoertuig, de wetenschappers hechtten eerst Tat-peptiden - die de kruising van het celkernmembraan vergemakkelijken - aan gouden nanodeeltjes. Vervolgens, het CRISPR-Cas9-plasmide dat het RNA bevat dat gericht is op het Plk-1-gen - waarvan de knock-out de tumorcelfunctie ernstig zou schaden - werd door elektrostatische interacties aan de Tat-peptiden gehecht, zodat ze hun lading zouden vrijgeven direct nadat ze de kern waren binnengegaan. Eindelijk, het nanoparticulaire systeem werd gecoat met een formulering van lipiden om de cellulaire opname te verbeteren.
Om het systeem te testen, cellen en tumordragende muizen werden beide toegediend met het CRISPR-Cas9-plasmide dragende nanogold-vehikel, en de release van de gen-editing machine werd veroorzaakt door een laser. "In dit onderzoek, bestraling met licht veroorzaakte de afgifte van het Tat-peptide uit de gouden nanodeeltjes op een tijd- en laserintensiteitsafhankelijke manier, " legden de auteurs uit. Andere benaderingen zijn ook mogelijk, zoals ze aangaven:aangezien de gouden nanodeeltjes opwarmen bij bestraling, ze zouden zelf als thermotherapeutische middelen kunnen dienen. Samengevat, dit relatief eenvoudige ontwerp met gouden nanodeeltjes, peptiden, en lipiden geassembleerd tot een geavanceerd multifunctioneel drager/afgiftesysteem zouden kunnen dienen als een multifunctioneel leveringsplatform voor verschillende aspecten van gentherapie.
 Wetenschappers ontwikkelen efficiënte multifunctionele katalysator voor CO2-hydrogenering tot benzine
Wetenschappers ontwikkelen efficiënte multifunctionele katalysator voor CO2-hydrogenering tot benzine Hoe te berekenen hoeveel ringen in een Atom
Hoe te berekenen hoeveel ringen in een Atom Blokkeren van suikerstructuren op virussen en tumorcellen
Blokkeren van suikerstructuren op virussen en tumorcellen Het leven van een schuim
Het leven van een schuim Biochar kan koolstofopslag stimuleren, maar voordelen voor kieming en groei lijken schaars
Biochar kan koolstofopslag stimuleren, maar voordelen voor kieming en groei lijken schaars
 The Differences in Woods, Forests & Jungles
The Differences in Woods, Forests & Jungles  Insecteneiwit heeft een groot potentieel om de ecologische voetafdruk van Europese consumenten te verkleinen
Insecteneiwit heeft een groot potentieel om de ecologische voetafdruk van Europese consumenten te verkleinen Het overstromingsrisico voor nieuwe woningen in Engeland en Wales zal toenemen in achterstandsgebieden
Het overstromingsrisico voor nieuwe woningen in Engeland en Wales zal toenemen in achterstandsgebieden Een op de drie rivieren op het Iberisch schiereiland wordt getroffen door verzilting
Een op de drie rivieren op het Iberisch schiereiland wordt getroffen door verzilting Fossiele bladeren vertonen een hoge atmosferische koolstof die de oude wereldwijde vergroening heeft gestimuleerd
Fossiele bladeren vertonen een hoge atmosferische koolstof die de oude wereldwijde vergroening heeft gestimuleerd
Hoofdlijnen
- Meer bewijs dat Neanderthalers niet dom waren:ze maakten hun eigen touwtje
- Welke vier dingen maken ribosomen anders dan organellen?
- Overeenkomsten van mitose en meiose
- Om nieuwe enzymen voor biobrandstoffen te vinden, het kan een microbieel dorp vergen
- Neurale opnames van wilde vleermuizen onthullen een unieke organisatie van het middenhersenengebied voor het volgen en vangen van prooien
- Celmuursamenstelling van de zes koninkrijken
- Antibioticaresistentie: definitie, oorzaken en voorbeelden
- Voors en tegens van Forensic Science
- Waarom hebben we grote hersenen?
 Onderzoek naar nieuwe manieren om secundair houtkapmateriaal te gebruiken
Onderzoek naar nieuwe manieren om secundair houtkapmateriaal te gebruiken Hoe de buitendiameter
Hoe de buitendiameter Onderzoek toont aan dat Afrikaanse immigranten in de VS het goed doen ondanks verschillen tussen hen
Onderzoek toont aan dat Afrikaanse immigranten in de VS het goed doen ondanks verschillen tussen hen Hoe fytoplankton overleeft in oceaangyres met een lage nutriëntenvoorziening
Hoe fytoplankton overleeft in oceaangyres met een lage nutriëntenvoorziening Ontwikkeling van silicium-metaalcomposietmateriaal voor oplaadbare lithium-ionbatterijen met hoge capaciteit
Ontwikkeling van silicium-metaalcomposietmateriaal voor oplaadbare lithium-ionbatterijen met hoge capaciteit Onderzoekstraject vermenigvuldigt aandeel onderzoekers
Onderzoekstraject vermenigvuldigt aandeel onderzoekers Intensiteit tropische cyclonen neemt waarschijnlijk toe door klimaatverandering
Intensiteit tropische cyclonen neemt waarschijnlijk toe door klimaatverandering Het kroonjuweel van de HL-LHC-magneten
Het kroonjuweel van de HL-LHC-magneten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Portuguese | Swedish | German | Dutch | Danish | Norway | Spanish |

-
Wetenschap © https://nl.scienceaq.com