
Wetenschap
Blokkeren van suikerstructuren op virussen en tumorcellen
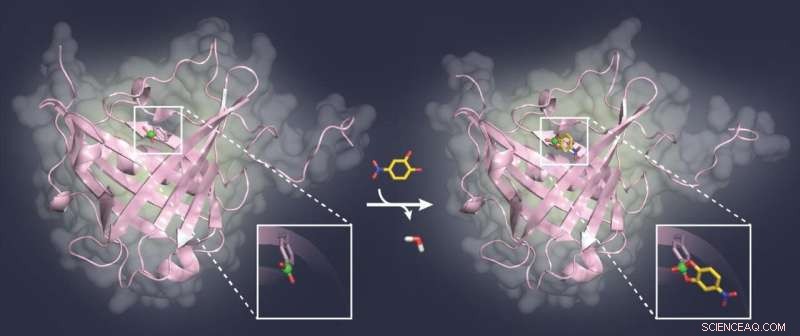
De huidige onderzoeksresultaten van prof. Skerra effenen de weg voor de ontwikkeling van nieuwe soorten bindende eiwitten voor biologische suikerstructuren, die een belangrijke rol spelen bij kanker en infectieziekten. - Wat je hier kunt zien:Een model suikerligand (geel) bindt aan de boorzuurgroep (groen) in de pocket van een bindend eiwit (roze). Credit:TUM-voorzitter van biologische chemie
Tijdens een virale infectie, virussen komen het lichaam binnen en vermenigvuldigen zich in zijn cellen. Virussen hechten zich vaak specifiek aan de suikerstructuren van de gastheercellen, of vertonen zelf karakteristieke suikerstructuren op hun oppervlak. Onderzoekers van de Technische Universiteit van München (TUM) hebben een nieuw type eiwitreagens ontwikkeld voor het identificeren van biologische suikerstructuren, die de verspreiding van een ziekte in het lichaam kan blokkeren indien gebruikt voor het blokkeren van de suikerstructuren van een cel of een pathogeen.
Het laboratorium onder leiding van Arne Skerra, Hoogleraar Biologische Chemie, heeft zijn focus op het ontwerpen van kunstmatige bindende eiwitten voor therapeutische toepassingen. De huidige onderzoeksresultaten van het laboratorium maken de weg vrij voor de ontwikkeling van nieuwe soorten bindende eiwitten voor biologische suikerstructuren, die een belangrijke rol spelen bij kanker en infectieziekten.
Herkennen van biologische suikerstructuren
"De herkenning van specifieke suikermoleculen, of zogenaamde koolhydraten, is van vitaal belang in veel biologische processen, " legt prof. Skerra uit. De meeste cellen dragen een marker die bestaat uit suikerketens die aan de buitenkant van het celmembraan of aan de membraaneiwitten zijn bevestigd, waardoor het lichaam kan identificeren waar deze cellen thuishoren of dat bepaalde cellen vreemd zijn. Ziekteverwekkers hebben ook hun eigen suikerstructuren, of ze kunnen hieraan binden.
eiwitten, die een breed scala aan functies binnen cellen vervullen, hebben over het algemeen slechts een lage affiniteit voor suikers. Dus, hun moleculaire herkenning vormt een uitdaging. De reden:watermoleculen lijken op suikermoleculen, wat betekent dat ze in principe verborgen zijn in de waterige omgeving van de cellen. De onderzoeksgroep van prof. Skerra ging daarom op zoek naar een kunstmatig bindend eiwit met een eigenaardige chemische samenstelling die het gemakkelijker maakt om zich te binden aan biologische suikerstructuren.
Een boorzuurgroep geïmplementeerd in een eiwit als aminozuur
Aminozuren zijn de bouwstenen van eiwitten. Als een regel, de natuur gebruikt slechts 20 aminozuren in alle levende organismen. "Gebruikmakend van de mogelijkheden die synthetische biologie biedt, we hebben een extra kunstmatig aminozuur gebruikt, " meldt onderzoeker Carina A. Sommer.
"We zijn erin geslaagd een boorzuurgroep op te nemen, die intrinsieke affiniteit uitoefent voor suikermoleculen, in de aminozuurketen van een eiwit. Door dit te doen, we hebben een geheel nieuwe klasse van bindende eiwitten voor suikermoleculen gecreëerd, " legt Sommer uit. Deze kunstmatige suikerbindende functie is superieur aan natuurlijke bindende eiwitten (zogenaamde lectines), zowel qua sterkte als met betrekking tot mogelijke suikerspecificiteiten.
"De suikerbindende activiteit van boorzuur en zijn derivaten is al bijna een eeuw bekend, " zegt Prof. Skerra. "Het scheikundige element borium komt veel voor op aarde en heeft een lage toxiciteit, maar tot dusverre is het grotendeels onontgonnen gebleven door organismen."
"Door röntgenkristallografie te gebruiken, we zijn erin geslaagd de kristalstructuur van een modelcomplex van dit kunstmatige eiwit te ontrafelen, waarmee we ons biomoleculaire concept konden valideren, " legt wetenschapper Dr. Andreas Eichinger uit.
De volgende stap:naar medische toepassing
Na ongeveer vijf jaar fundamenteel wetenschappelijk onderzoek, de bevindingen van het laboratorium van prof. Skerra kunnen nu worden toegepast op praktische medische behoeften. Prof. Skerra wijst erop:"Onze resultaten moeten niet alleen worden gebruikt om de toekomstige ontwikkeling van nieuwe koolhydraatliganden in de biologische chemie te ondersteunen, maar zou ook de weg moeten effenen voor het creëren van middelen met hoge affiniteit voor het controleren of blokkeren van medisch relevante suikerstructuren op celoppervlakken."
Een dergelijk "blokkerend middel" zou kunnen worden gebruikt voor aandoeningen waarbij sterke celgroei duidelijk is of wanneer pathogenen zich aan cellen hechten, bijvoorbeeld in oncologie en virologie. Als we erin slagen de suikerbindende functie te blokkeren en de voortgang van een ziekte te vertragen, dit zou het immuunsysteem van de patiënt voldoende tijd geven om de natuurlijke afweer van het lichaam te mobiliseren.
 Kleuren experimenten met voedsel
Kleuren experimenten met voedsel  Van zee-egelskelet tot zonnecel
Van zee-egelskelet tot zonnecel Platina-grafeen brandstofcelkatalysatoren vertonen superieure stabiliteit ten opzichte van platina in bulk
Platina-grafeen brandstofcelkatalysatoren vertonen superieure stabiliteit ten opzichte van platina in bulk Een snelle malariatestkit die de diagnose in ontwikkelingslanden kan helpen
Een snelle malariatestkit die de diagnose in ontwikkelingslanden kan helpen Hoe de geleidbaarheid te berekenen vanwege concentratie
Hoe de geleidbaarheid te berekenen vanwege concentratie
 Hoe orkanen zoals Irma en Maria het Caribische mariene milieu kunnen verwoesten
Hoe orkanen zoals Irma en Maria het Caribische mariene milieu kunnen verwoesten Peulvruchten essentieel voor het ondersteunen van de groei van tropische bossen
Peulvruchten essentieel voor het ondersteunen van de groei van tropische bossen Klimaatextremen belangrijkste drijfveer achter toenemende honger wereldwijd:VN
Klimaatextremen belangrijkste drijfveer achter toenemende honger wereldwijd:VN Lijst met ecosystemen
Lijst met ecosystemen  De Amerikaanse kastanje herstellen door zijn genoom te onderzoeken
De Amerikaanse kastanje herstellen door zijn genoom te onderzoeken
Hoofdlijnen
- Hoeveel Valence-elektronen heeft natrium?
- Onderzoek naar parasieten effent de weg voor infectietherapieën
- De Krebs-cyclus en de Homeostasis
- Wat is opsomming in de microbiologie?
- Analyse van oud DNA onthult een voorheen niet-herkend geslacht van uitgestorven paarden dat ooit door Noord-Amerika zwierf
- Fysische en chemische eigenschappen van lipiden
- Onderzoekers identificeren een paar receptoren die essentieel zijn voor de communicatie tussen mannen en vrouwen bij planten
- Wat gebeurt er als je een lijk ontdooit?
- Voordelen van embryonale stamcelonderzoek
- Bij nadere beschouwing blijkt uit magnesium dat zeer kleine monsters veel kneedbaarder zijn dan gedacht

- Op zoek naar de chemie van het leven

- Chemische neus snuffelt kritische verschillen in DNA-structuren
- Nieuw materiaal biedt milieuvriendelijke oplossing om restwarmte om te zetten in energie

- Gezonde organellen, gezonde cellen

 Vaarwel Cassini:ruimtevaartuig Saturnus krijgt grappige opera-uitzending
Vaarwel Cassini:ruimtevaartuig Saturnus krijgt grappige opera-uitzending Stergeboorte met kans op wind?
Stergeboorte met kans op wind? Airbus verhoogt productie van A320-vliegtuigen in de VS
Airbus verhoogt productie van A320-vliegtuigen in de VS Materialen kunnen vorst tot 300 keer langer uitstellen dan bestaande anti-ijsafzettingen
Materialen kunnen vorst tot 300 keer langer uitstellen dan bestaande anti-ijsafzettingen Nieuw additief helpt onderzoekers om CO2 selectiever om te zetten in multicarbon-brandstoffen
Nieuw additief helpt onderzoekers om CO2 selectiever om te zetten in multicarbon-brandstoffen Diepzeetransportbandstroom zorgt voor tsunami-risico voor Falklandeilanden
Diepzeetransportbandstroom zorgt voor tsunami-risico voor Falklandeilanden De detectie van fosfine in Venuswolken is een groot probleem, en hier is hoe we erachter kunnen komen of het echt leven is
De detectie van fosfine in Venuswolken is een groot probleem, en hier is hoe we erachter kunnen komen of het echt leven is Virusoppervlakken helpen ingenieurs bij het bestuderen van toepassingen voor vaccins en gentherapie
Virusoppervlakken helpen ingenieurs bij het bestuderen van toepassingen voor vaccins en gentherapie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- Italian | Spanish | Swedish | German | Dutch | Danish | Norway | French | Portuguese |

-
Wetenschap © https://nl.scienceaq.com

