
Wetenschap
Team past virus op nanoschaal aan om peptidegeneesmiddelen aan cellen te leveren, weefsels
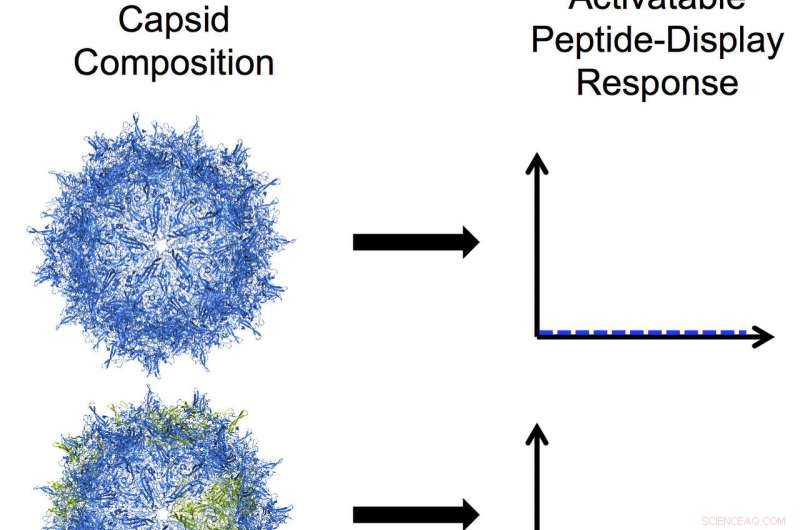
De bio-ingenieurs van Rice University hebben programmeerbare adeno-geassocieerde virussen ontwikkeld door een van de drie eiwitten te modificeren die samenkomen in een taai omhulsel dat een capside wordt genoemd. In deze illustratie, blauwe subeenheden in de capside vertegenwoordigen het eiwit VP3 en groene subeenheden vertegenwoordigen een afgeknotte mutant van VP2. Van boven naar beneden:een VP3-only capside die geen peptiden vertoont; een mozaïekcapside met een meerderheid van VP3 en een kleine hoeveelheid van de VP2-mutant die een laag niveau van activeerbare peptideweergave vertoont; een mozaïekcapside met gelijke hoeveelheden VP3- en VP2-mutant die een hoog niveau van activeerbare peptideweergave vertoont; en een homomeer VP2-mutant capside met een hoog niveau van constant, borstelachtige peptideweergave. Krediet:Nicole Thadani/Rice University
Door een viraal eiwit weg te hakken, Wetenschappers van Rice University hebben een pad ontdekt naar virusachtige, apparaten op nanoschaal die mogelijk medicijnen aan cellen kunnen leveren.
Het eiwit is een van de drie die de beschermende schaal vormen, de capside genoemd, van natuurlijke adeno-geassocieerde virussen (AAV). Door steeds kleinere versies van het eiwit te maken, de onderzoekers maakten capsiden met unieke capaciteiten en leerden veel over de mechanismen van AAV.
Het onderzoek verschijnt in het tijdschrift American Chemical Society ACS Nano .
Rijstbio-ingenieur Junghae Suh bestudeert de manipulatie van niet-ziekteverwekkende AAV's om nuttige ladingen zoals chemotherapiemedicijnen af te leveren. Haar onderzoek heeft geleid tot de ontwikkeling van virussen die kunnen worden geactiveerd door licht of door extracellulaire proteasen die geassocieerd zijn met bepaalde ziekten.
AAV's zijn klein - ongeveer 25 nanometer - en bevatten een enkele DNA-streng in taaie capsiden die bestaat uit een mozaïek van eiwitten die bekend staat als VP1, VP2 en VP3. AAV's zijn gebruikt om gentherapie-payloads te leveren, maar niemand heeft ontdekt hoe AAV-capsiden zichzelf fysiek herconfigureren wanneer ze worden geactiveerd door externe stimuli. Zo zei. Dat was het uitgangspunt voor haar lab.
"Dit virus heeft intrinsieke peptide (kleine eiwit) domeinen verborgen in de capside, ' zei ze. 'Als het virus een cel infecteert, het detecteert de lage pH en andere endosomale factoren, en deze peptidedomeinen komen uit op het oppervlak van de viruscapside.
"Deze conformatieverandering, die we een 'activeerbare peptideweergave' noemden, ' is belangrijk voor het virus omdat de geëxternaliseerde domeinen het endosomale membraan afbreken en het virus in het cytoplasma laten ontsnappen, "Zei Suh. "Bovendien, nucleaire lokalisatiesequenties in die domeinen zorgen ervoor dat het virus de kern binnengaat. We dachten dat we die functionaliteit door iets anders konden vervangen."

Nicole Thadani, links, en Junghae Suh van Rice University hebben programmeerbare adeno-geassocieerde virussen ontwikkeld die kunnen worden gebruikt om peptidegeneesmiddelen af te leveren. Krediet:Jeff Fitlow/Rice University
Suh en hoofdauteur en Rice afgestudeerde student Nicole Thadani denken dat hun gemuteerde AAV's "biocomputing nanodeeltjes" kunnen worden die milieu-inputs detecteren en verwerken en controleerbare outputs produceren. Het wijzigen van de capside is de eerste stap.
Van de drie natuurlijke capside-eiwitten, alleen VP1 en VP2 kunnen worden geactiveerd om hun functionele peptiden bloot te leggen, maar geen van beide kan op zichzelf een capside maken. Kortere VP3's kunnen zelf capsiden vormen, maar geen peptiden weergeven. In natuurlijke AAV's, VP3-eiwitten overtreffen elk van hun compadres 10-tegen-1.
Dat beperkt het aantal peptiden dat kan worden blootgesteld, dus zo, Thadani en hun co-auteurs wilden de verhouding veranderen. Dat bracht hen ertoe VP2 af te kappen en mozaïekcapsiden te synthetiseren met VP3, resulterend in een succesvolle wijziging van het aantal blootgestelde peptiden. Op basis van eerder onderzoek, ze voegden een gemeenschappelijke hexahistidine-tag in die het gemakkelijk maakte om de oppervlakteweergave van het peptidegebied te volgen.
"We wilden de activeerbare eigenschap van het eiwit een boost geven die verder gaat dan wat er in het oorspronkelijke viruscapside voorkomt, " zei Thadani. "In plaats van slechts vijf exemplaren van het peptide per capside weer te geven, nu kunnen we misschien 20 of 30 tonen en meer van de biologische activiteit krijgen die we willen."
Vervolgens maakten ze een afgeknotte VP2 die op zichzelf een capside kon vormen. "De resultaten waren nogal verrassend, en voor ons niet duidelijk, Suh zei. "We hebben die VP2-component voldoende omgehakt om te vormen wat we een homomere capside noemen, waarbij de hele capside uit alleen die mutante subeenheid bestaat. Dat gaf ons virussen die peptide 'borstels' lijken te hebben die altijd aan de oppervlakte zijn.
"Zo'n virale structuur is nog nooit in de natuur gezien, "zei ze. "We hebben een deeltje met deze peptideborstel, met overal losse eindjes. Nu willen we weten of we deze losse eindjes kunnen gebruiken om andere dingen aan te bevestigen of andere functies uit te voeren."
Homomere AAV's vertonen maar liefst 60 peptiden, terwijl mozaïek-AAV's kunnen worden geprogrammeerd om te reageren op stimuli die specifiek zijn voor bepaalde cellen of weefsels en een kleiner gewenst aantal peptiden weer te geven, aldus de onderzoekers.
"Virussen zijn geëvolueerd om cellen zeer effectief binnen te vallen, " zei Suh. "We willen ons virus gebruiken als een platform voor nanodeeltjes om op eiwitten of peptiden gebaseerde therapieën efficiënter in cellen af te leveren. We willen benutten wat de natuur al heeft gecreëerd, tweak het een beetje en gebruik het voor onze doeleinden."
 Als A.I. had een brein - ingenieurs modelleren een kunstmatige synaps naar het menselijk brein
Als A.I. had een brein - ingenieurs modelleren een kunstmatige synaps naar het menselijk brein Solid-ion-geleiders voor veiligere batterijen
Solid-ion-geleiders voor veiligere batterijen Biocompatibele fotonische kristallen breiden toepassingen uit van optica tot medicijnen
Biocompatibele fotonische kristallen breiden toepassingen uit van optica tot medicijnen Onderzoeksteam bewaart therapieën in poedervorm in proof-of-concept-experiment
Onderzoeksteam bewaart therapieën in poedervorm in proof-of-concept-experiment Aerogels voor zonne-apparaten en ramen
Aerogels voor zonne-apparaten en ramen
 Late winterstormen verlichten Californiës duiken terug in droogte
Late winterstormen verlichten Californiës duiken terug in droogte Faeröer een weekend dicht om het milieu te beschermen
Faeröer een weekend dicht om het milieu te beschermen Zware oliën en petroleumcokes verhogen de uitstoot van vanadium
Zware oliën en petroleumcokes verhogen de uitstoot van vanadium Het effect van aluminium blikjes op de omgeving
Het effect van aluminium blikjes op de omgeving Londen in 2050 net zo hot als Barcelona? Ik onderzoek stadswarmte, en ik ben sceptisch
Londen in 2050 net zo hot als Barcelona? Ik onderzoek stadswarmte, en ik ben sceptisch
Hoofdlijnen
- Droogte geen dingo's achter het uitsterven van tijgers op het vasteland van Australië:studie
- Chromatid: wat is het?
- Vroege bloeiers:statistische tool onthult effecten van klimaatverandering op planten
- Een betere manier om pesticiden van appels te wassen
- Hoe zijn cellen, weefsels en organen verwant?
- Handelen of niet handelen? De ivoren impasse doorbreken
- 10 tips van gelukkige mensen
- Wat betekent ion?
- Recombinante DNA-technologie voor vaccinontwikkeling
- Laat er licht zijn:gecontroleerde creatie van kwantumemitterarrays

- Van lab tot industrie? Ideaal bestelde poreuze titania films, op schaal gemaakt
- Natuurkundigen hebben nieuwe eigenschappen van Yakutia-diamanten onthuld

- Hybride nanostructuur met extreme lichtabsorptie ziet er veelbelovend uit voor fotovoltaïsche energie

- Ingenieurs bouwen eerste sub-10-nm koolstof nanobuistransistor
 Stedelijk regenwateronderzoek vindt weinig verschil tussen beheerde, onbeheerde stromen
Stedelijk regenwateronderzoek vindt weinig verschil tussen beheerde, onbeheerde stromen Hoe Bunker Busters werken
Hoe Bunker Busters werken  De kruising van 3D-printen en machine learning
De kruising van 3D-printen en machine learning Zeehonden versus Walruses
Zeehonden versus Walruses  Studie:nanostructuren houden belofte zo snel, kleine RRAM-schakelaars
Studie:nanostructuren houden belofte zo snel, kleine RRAM-schakelaars Duitse luchtmacht weigert levering van twee Airbus-vliegtuigen
Duitse luchtmacht weigert levering van twee Airbus-vliegtuigen Regionale ongelijkheid neemt niet af in lage- en middeninkomenslanden
Regionale ongelijkheid neemt niet af in lage- en middeninkomenslanden ABB onthult EV-oplader, kan 200 km actieradius toevoegen in 8 minuten
ABB onthult EV-oplader, kan 200 km actieradius toevoegen in 8 minuten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Portuguese | Swedish | German | Dutch | Danish | Norway | Spanish |

-
Wetenschap © https://nl.scienceaq.com

