
Wetenschap
De golflengte van fluorescerende koolstofbuizen afstemmen
Koolstof is niet alleen het belangrijkste element voor het leven, het heeft ook fascinerende eigen eigenschappen. Grafeen - een pure koolstofplaat van slechts één atoom dik - is een van de sterkste materialen. Rol grafeen in een cilinder en je krijgt koolstofnanobuisjes (CNT's), de sleutel tot veel opkomende technologieën.
Nutsvoorzieningen, in een studie gerapporteerd in Chemische communicatie , onderzoekers van de Japanse Kyushu University leerden de fluorescentie van CNT's te beheersen, mogelijk nieuwe toepassingen toelaten.
CNT's zijn van nature fluorescerend - wanneer ze onder licht worden geplaatst, ze reageren door hun eigen licht vrij te geven, een proces dat fotoluminescentie wordt genoemd. De golflengte (kleur) van fluorescentie hangt af van de structuur van de buizen, zoals de hoek waaronder ze worden gerold. Fluorescerende CNT's zijn onderzocht voor gebruik in LED-verlichting en medische beeldvorming.
Het Kyushu-team streefde naar een betere controle over de emissiegolflengte. "Fluorescentie treedt op wanneer elektronen energie van licht gebruiken om in hogere orbitalen rond atomen te springen, " leggen de hoofdauteurs uit. "Ze zinken terug naar een lagere orbitaal, laat dan overtollige energie vrij in de vorm van licht. De golflengte van het uitgestraalde licht verschilt van het ingangslicht, afhankelijk van de energie van de emitterende orbitaal." Hoewel fluorescentie vaak wordt geassocieerd met gele materialen, de fluorescentie van deze CNT's is infrarood, die onzichtbaar is voor het oog, maar kan worden gedetecteerd door sensoren.
De onderzoekers gebruikten chemie om organische moleculen - zeshoeken van koolstofatomen - aan de CNT's te binden. Dit duwde de orbitalen omhoog of omlaag, dus het afstemmen van de fluorescentie. Een van de zes atomen in elke zeshoek was gebonden aan een CNT, verankering van het molecuul aan de buis. Een andere was gebonden aan een extra groep atomen (een substituent). Door de zeshoekige vorm, de twee gebonden koolstofatomen kunnen aangrenzend zijn (aangeduid met "o"), of gescheiden door één koolstof ("m"), of door twee ("p"). De meeste studies gebruiken de "p" -regeling, waar de substituent weg wijst van de CNT, maar het Kyushu-team vergeleek ze alle drie.
Het "o"-patroon produceerde heel andere fluorescentie dan "m" en "p" - in plaats van één infraroodgolflengte, de CNT's stootten er nu twee uit. Dit was het gevolg van vervorming van de buizen door de substituenten, die tegen de buiswanden werden gedrukt. In de tussentijd, voor de "m" en "p" regelingen, de energieën waren afhankelijk van welke elementen zich in de substituent bevonden. Bijvoorbeeld, NO2 produceerde grotere openingen tussen orbitalen dan broom. Dit was geen verrassing, omdat NO2 beter is in het aantrekken van elektronen, het creëren van een elektrisch veld (dipool). Echter, de grootte van het effect verschilde tussen "m" en "p."
"De variatie in orbitale energieën met verschillende substituenten geeft ons een fijne controle over de emissiegolflengte van CNT's over een breed bereik, " zeggen de auteurs. "Het belangrijkste resultaat is om te begrijpen hoe dipolen de fluorescentie beïnvloeden, dus we kunnen rationeel CNT's ontwerpen met de zeer precieze golflengten die biomedische apparaten nodig hebben. Dit kan heel belangrijk zijn voor de ontwikkeling van bio-imaging in de nabije toekomst."
Het artikel, "Nabij-infraroodfotoluminescentiemodulatie door ontwerp van defectlocaties met behulp van arylisomeren in lokaal gefunctionaliseerde enkelwandige koolstofnanobuizen, " werd gepubliceerd in Chemische communicatie .
 Inzichten op atoomniveau helpen de degradatie in brandstofcellen te verminderen en hun levensduur te verlengen
Inzichten op atoomniveau helpen de degradatie in brandstofcellen te verminderen en hun levensduur te verlengen Door de natuur geïnspireerde proteïne kan helpen bij de plasticplaag
Door de natuur geïnspireerde proteïne kan helpen bij de plasticplaag Efficiënte katalysator ontwikkeld voor het produceren van pronucleotiden
Efficiënte katalysator ontwikkeld voor het produceren van pronucleotiden Door wolfraam vervangen vanadiumoxide ademt frisse lucht in de katalysatortechnologie
Door wolfraam vervangen vanadiumoxide ademt frisse lucht in de katalysatortechnologie Nieuwe chemie maakt verbeteringen aan magische medicijnen gemakkelijker
Nieuwe chemie maakt verbeteringen aan magische medicijnen gemakkelijker
 Milieuvriendelijke landbouwpraktijken die worden gebruikt door bijna 1/3 van de boerderijen ter wereld
Milieuvriendelijke landbouwpraktijken die worden gebruikt door bijna 1/3 van de boerderijen ter wereld Nieuw rapport onderzoekt de belangrijkste stappen bij het verwijderen van kooldioxide uit de lucht
Nieuw rapport onderzoekt de belangrijkste stappen bij het verwijderen van kooldioxide uit de lucht 2020-emissies:precedent scheppen of tegen de trend in?
2020-emissies:precedent scheppen of tegen de trend in? Waarom Canada zijn netto-nul-belofte om de CO2-uitstoot te verminderen moet laten vallen?
Waarom Canada zijn netto-nul-belofte om de CO2-uitstoot te verminderen moet laten vallen? Chinese stad annuleert vluchten in 2e dag van smogalarm
Chinese stad annuleert vluchten in 2e dag van smogalarm
Hoofdlijnen
- Hoe maak je een plantencelmodel op stap-voor-stap
- Soorten monomeren
- Door het bedrijf gesponsorde klinische CRISPR-onderzoeken starten in 2018
- Wat is het voordeel van het gebruik van vlekken om naar cellen te kijken?
- Is uitsterven ooit een goede zaak?
- Luipaarden doden minstens 3 kinderen op het Indiase platteland
- Forensische wetenschapsprojecten voor middelbare scholieren
- Virusstamping - een veelzijdige nieuwe methode voor genetische manipulatie van afzonderlijke cellen
- Klimaatverandering zal naar verwachting kleiner worden, gestalte van dominante Midwest-plant, studie vondsten
- Snel 3D-printen in water met behulp van nieuwe hybride nanodeeltjes

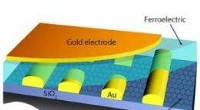
- Niet-vluchtig geheugen op basis van ferro-elektrische grafeen-veldeffecttransistoren is nu een stap dichter bij de realiteit
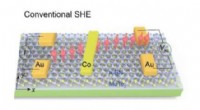
- Het verdunnen van Weyl-halfmetalen geeft een nieuwe draai aan spintronica
- Nanotechnologen moeten lessen trekken uit de natuur

- Onderzoekers detecteren spin-precessie in nanodraden van silicium

 Computeren met lichtspins
Computeren met lichtspins Onderzoekers confronteren grote hindernis in quantum computing
Onderzoekers confronteren grote hindernis in quantum computing Enkel nanomateriaal levert veel laserkleuren op
Enkel nanomateriaal levert veel laserkleuren op Door NASA gefinancierde website laat het publiek zoeken naar nieuwe nabije werelden
Door NASA gefinancierde website laat het publiek zoeken naar nieuwe nabije werelden Nieuw transistorconcept, zonnecel inbegrepen
Nieuw transistorconcept, zonnecel inbegrepen 6 coole innovaties die vliegreizen voor altijd kunnen veranderen
6 coole innovaties die vliegreizen voor altijd kunnen veranderen  Bosbranden aan oostkust van Australië uit de hand gelopen
Bosbranden aan oostkust van Australië uit de hand gelopen Bedreigde soorten in de Afrikaanse savanne
Bedreigde soorten in de Afrikaanse savanne
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

