
Wetenschap
De nucleaire poriedynamiek van colonkanker wordt vastgelegd door HS-AFM
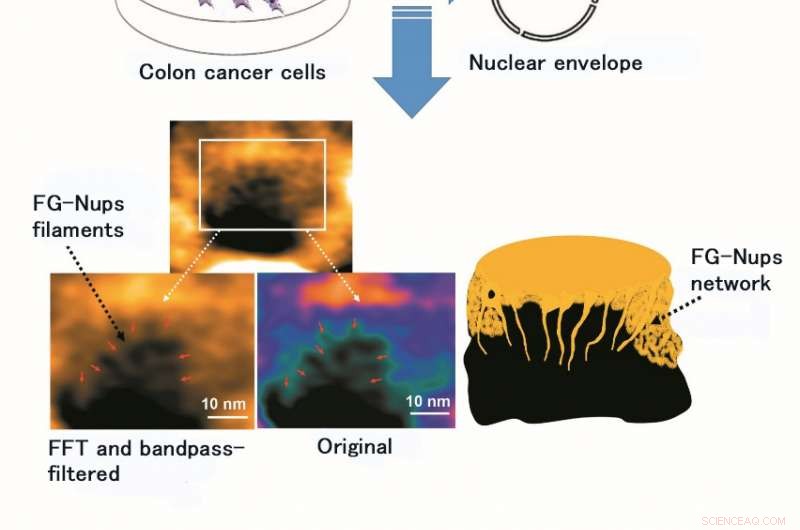
Gebruik van HS-AFM maakte observatie en videobeeldvorming van de structuur en dynamiek van FG-Nups-filament mogelijk, een eiwitcomplex van zachte en flexibele voering. De afbeelding toont het originele beeld van FG-Nups-filament en dat na verwerking door Fast Fourier Transform (FFT) en een banddoorlaatfilter (een banddoorlaatfilter laat alleen permeatie van licht van bepaalde golflengten toe). Krediet:Kanazawa University
Een van de belangrijkste redenen voor kankersterfte is het zeer invasieve gedrag van kankercellen, wat vaak te wijten is aan agressieve metastasen. Metastase wordt vergemakkelijkt door verschillende groeifactoren en cytokinen die worden uitgescheiden door cellen van het immuunsysteem, die via verschillende signaalroutes werken. Opmerkelijk, deze signaalroutes komen de kern binnen via het nucleaire poriecomplex (NPC), die geacht wordt op te treden als een poortwachter naar de kern. NPC is, in feite, een nanomachine bestaande uit meerdere kopieën van ongeveer 30 verschillende eiwitten, gezamenlijk nucleoporine genoemd.
Hoewel kleine moleculen vrij vrij door de kernporiën kunnen gaan, moleculen groter dan 40 kDa zouden dit alleen effectief kunnen doen door te binden aan specifieke transporteiwitten die interageren met FG-Nups (nucleoporines hebben herhalende eenheden van twee aminozuren fenylalanine (F) en glycine (G), dat zijn de tentakel-eiwitten met specifieke en selectieve rollen bij het transport van poriën. Hoewel er verschillende modellen worden voorgesteld, hoe FG-Nups deelneemt aan het kern-cytoplasmatransport blijft grotendeels onbekend. Niettemin, de gelijktijdige beoordeling van nanoscopische structuren en dynamiek is technisch niet haalbaar, een situatie die in heel celbiologisch onderzoek heerst. De directe visualisatie van NPC-dynamiek bij resolutie op nanoschaal werd als onmogelijk beschouwd.
Het onderzoeksteam van Kanazawa University heeft dit belangrijke probleem onderzocht en de baanbrekende resultaten verkregen door gecombineerde live-celbeeldvorming met hoge resolutie, elektronenmicroscopie, en high-speed AFM (HS-AFM) die door henzelf is ontwikkeld om de natieve nanoscopische ruimtelijke en temporele dynamiek in NPC-structuren in de darmkankercellen te onderzoeken.
Eerst, ze genereerden NPC-stabiele cellijnen die GFP (groen fluorescerend eiwit) tot expressie brachten en bevestigd door fluorescentiemicroscopie. Volgende, ze isoleerden de sterk gezuiverde nucleaire envelop die werd bevestigd door het gebruik van negatieve kleurelektronenmicroscopie en confocale microscopie. Vervolgens, ze begonnen met het observeren van spatiotemporele veranderingen op milliseconden- en nanometerschaal van de NPC-structuur in de oorspronkelijke toestand in darmkankercellen door live-celbeeldvorming met hoge resolutie en elektronenmicroscopie te combineren. Opmerkelijk, ze voerden de observatie uit van levende nucleaire envelop en nucleaire poriën met behulp van HS-AFM.
Het onderzoeksteam van Kanazawa University was, inderdaad, succesvol in het in beeld brengen van de dynamiek van NPC-eiwitten in kankercellen, die de bouwstenen zijn van de kernporie (Figuur 1). MLN8237/alisertib, een apoptotische en autofagische inductor, ondergaat momenteel verschillende klinische onderzoeken naar kanker. Van dit medicijn werd gemeld dat het de expressie en activiteiten van nucleoporine remt. De onderzoekers visualiseerden inheemse en met medicijnen behandelde FG-Nups door HS-AFM. Vooral, de verlengde en ingetrokken FG-Nups met het uiterlijk van een spinnenweb gingen verloren in met geneesmiddel behandelde monsters (Figuur 2). Het onderzoeksteam concludeerde dat via HS-AFM, ze visualiseerden de vervorming en het verlies van FG-Nups nucleaire poriebarrière, wat misschien wel de eerste nano-sterfcode is die ter wereld is ontdekt.
De huidige studie door het onderzoeksteam van Kanazawa University maakte visualisatie van de structuur en dynamiek van de kernmembraanporie op nanometerschaal mogelijk, en het is aangetoond dat vervorming en verlies van de poriënbarrière van het kernmembraan een van de stervende codes van kankercellen zou zijn. Deze bevindingen staan voor een nieuw paradigma in ons begrip van nucleair transport, welke heeft, tot dit punt, bleef een raadselachtig probleem op het gebied van nanogeneeskunde en celbiologie. De huidige bevindingen zijn gebaseerd op de bekronende bio-imaging-technologie die is ontwikkeld aan de Kanazawa University. Deze studie heeft medische toepassingen, waaronder het optreden als een nieuwe "nano-endoscopie" om intracellulaire organellen zoals de kern en kernporiën te visualiseren, en moleculaire dynamiek in kankercellen en andere ziekten.
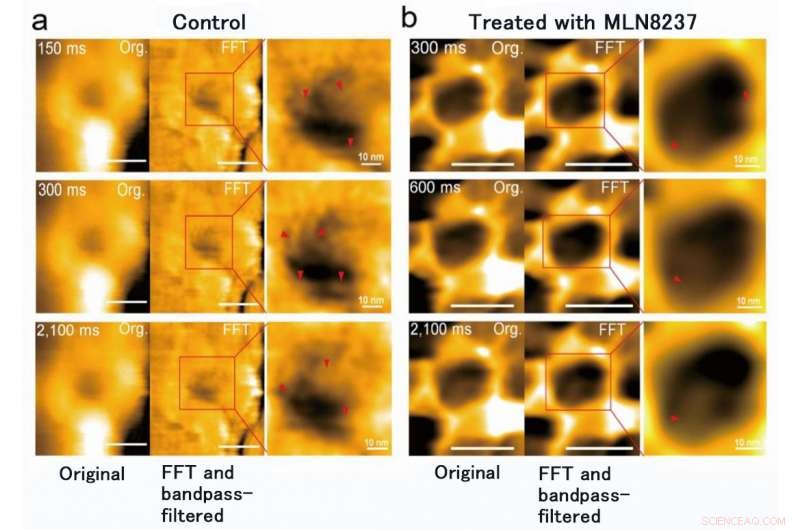
MLN8237-behandeling van kankercellen veroorzaakte vervorming en verlies van de FG-Nups-barrière. Er werd ook gevonden dat de binnendiameter van de kernporie veranderde van 86 ± 13 nm tot 53 ± 9 nm en de diepte, van 4 ± 2 nm tot 7 ± 1 nm. Krediet:Kanazawa University
 Glycerol Vs. Minerale olie
Glycerol Vs. Minerale olie  Dubbele emulsies in magere melk met minimale food-grade emulgatoren voor magere kaas
Dubbele emulsies in magere melk met minimale food-grade emulgatoren voor magere kaas Bio-geïnspireerde materialen - lenen uit het speelboek van de natuur
Bio-geïnspireerde materialen - lenen uit het speelboek van de natuur Siliconen smeermiddel Gebruiken
Siliconen smeermiddel Gebruiken Onderzoek identificeert een eenvoudigere manier om te voorspellen hoe chemische verbindingen zullen interageren
Onderzoek identificeert een eenvoudigere manier om te voorspellen hoe chemische verbindingen zullen interageren
 Aardgas belangrijkste bron van elektriciteitsemissies in de EU
Aardgas belangrijkste bron van elektriciteitsemissies in de EU Studie kijkt naar kwetsbaarheid aardbeving San Francisco
Studie kijkt naar kwetsbaarheid aardbeving San Francisco Rapport koppelt 's werelds grootste vleesbedrijf aan ontbossing
Rapport koppelt 's werelds grootste vleesbedrijf aan ontbossing Groene gebouwen moeten meer doen om onze klimaatnoodsituatie op te lossen
Groene gebouwen moeten meer doen om onze klimaatnoodsituatie op te lossen Oude schedel die waarschijnlijk toebehoort aan 's werelds oudste tsunami-slachtoffer
Oude schedel die waarschijnlijk toebehoort aan 's werelds oudste tsunami-slachtoffer
Hoofdlijnen
- Drie soorten vezelig bindweefsel
- Schimmelmicroben als biomeststoffen in landbouw en tuinieren:is de beloning groter dan het risico?
- Stappen van DNA-transcriptie
- CMU-software assembleert RNA-transcripten nauwkeuriger
- 5 waargebeurde verhalen over een bij de geboorte gescheiden tweeling
- Wat zijn de verschillen van eenvoudig en gestratificeerd weefsel?
- Brandende chili houdt olifanten op afstand, nieuwe studie vondsten
- Heeft Kelp veel verschillende cellen?
- Verschil tussen een gesloten en open bloedsomloop
- Gevoelige en selectieve detectie van koolstofnanobuisjes via fotoluminescentie
- Onderzoeker maakt techniek voor metingen op nanoschaal met licht

- Grafeen verandert elastische eigenschappen afhankelijk van de uitgeoefende kracht
- Watersplitsing waargenomen op nanometerschaal

- Tweedimensionale materialen zien groeien

 Terugtrekkende sneeuwgrens onthult organische moleculen rond jonge ster
Terugtrekkende sneeuwgrens onthult organische moleculen rond jonge ster Rolling Stones krijgen naam op kleine Marsrots die rolde
Rolling Stones krijgen naam op kleine Marsrots die rolde De waterstofeconomie een zuurtest geven
De waterstofeconomie een zuurtest geven Hoe massa van dichtheid te vinden
Hoe massa van dichtheid te vinden  Indiase astronomen onderzoeken magnetar CXOU J010043.1−721134
Indiase astronomen onderzoeken magnetar CXOU J010043.1−721134 Een eenvoudiger proces om germanium-nanodraden te laten groeien, zou de lithium-ionbatterijen kunnen verbeteren
Een eenvoudiger proces om germanium-nanodraden te laten groeien, zou de lithium-ionbatterijen kunnen verbeteren Coral vertelt eigen verhaal over El Ninos verleden
Coral vertelt eigen verhaal over El Ninos verleden Gebroken ijskappen op Mars
Gebroken ijskappen op Mars
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

