
Wetenschap
Neutronen onthullen potentiële gevaren van gouden nanodeeltjes - farmaceutische medicijnafleveringsagent van de toekomst
Wetenschappers van het Institut Laue-Langevin hebben aangetoond dat de lading van gouden nanodeeltjes, door grote farmaceutische bedrijven geïdentificeerd als medicijnafgiftemiddel van de toekomst voor de behandeling van kanker, beïnvloedt hoe ze omgaan met de beschermende buitenwand van onze cel. Deze cruciale inzichten, gepubliceerd in Langmuir , bieden een eerste stap in het effectieve ontwerp van veilige nanodeeltjes voor biomedische toepassingen en de praktijken en procedures voor hun veilige behandeling in een verscheidenheid aan andere consumentenproducten.
Het toenemende gebruik van nanodeeltjes, kleine vlokken van materiaal, 1 miljoenste zo groot als een zandkorrel, in een breed scala aan commerciële producten, zoals kleding, de containers van de voedselopslag, geneesmiddelen, cosmetica, banden, elektronica en optische apparaten, is controversieel. Veel voorkomende nanodeeltjes, zoals goud, zilver en koper, gemakkelijk doordringen in organische membranen, (gevangenismuren, ...) met mogelijk aanzienlijke gevolgen voor de menselijke gezondheid en het milieu. Echter, er is een gebied waar hun giftigheid nuttig en zelfs levensreddend kan blijken.
Een grote uitdaging in de moderne geneeskunde is het vinden van afgiftemiddelen die cellen kunnen targeten en penetreren om medicijnen rechtstreeks in het geïnfecteerde weefsel te transporteren. De zoektocht naar het juiste voertuig heeft geleid tot een nieuw onderzoeksgebied, 'nanogeneeskunde', waar nanodeeltjes kunnen worden geprogrammeerd om zich bijvoorbeeld op kankercellen te richten, het verminderen of zelfs elimineren van de noodzaak van een operatie.
Van alle nanodeeltjes waarover de medische wetenschap beschikt, een in het bijzonder is een focus van onderzoek geworden bij grote farmaceutische bedrijven - goud. AstraZeneca kondigde vorig jaar een nieuw onderzoeksproject aan om te kijken naar een nieuw nanomedicijn, CYT-6091, op basis van gouden nanodeeltjes.
Gouden nanodeeltjes zijn bijzonder goede bezorgvoertuigen omdat:
- Ze zijn gemakkelijk 'op te laden' met andere moleculen, zoals bestaande geneesmiddelen tegen kanker
- Ze zijn gemakkelijk te produceren
- Ze zijn chemisch stabiel in het lichaam
- Ze bieden een unieke set optische, elektronische en thermische eigenschappen, wat betekent dat ze heel gemakkelijk in het lichaam kunnen worden 'aangezet' wanneer ze op de juiste locatie aankomen.
Echter, op dit moment begrijpen we de interactiemechanismen tussen nanodeeltjes en de buitenste afweer van onze cel - het celmembraan - niet in detail. Zonder dit is het onmogelijk om te bepalen hoe gevaarlijk ze zijn en of hun vermogen om cellen binnen te dringen en te vernietigen ooit voor goede doelen kan worden gebruikt, zoals in de strijd tegen kanker.
Een ding dat bekend is, is dat er een complexe set parameters is die deze interactie beïnvloeden, inclusief de vorm van het nanodeeltje, maat, samenstelling en lading. Maar een systematische studie die laat zien hoe de interactie op moleculair niveau van deze parameters afhangt, ontbrak tot nu toe.
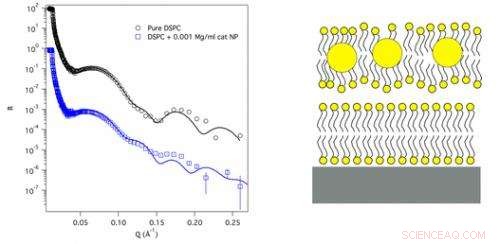
Om dit aan te pakken, een onderzoeksteam van het Institut Laue-Langevin (ILL), de University of Illinois en de Australian Nuclear Science and Technology Organization gebruikten de ILL-neutronen en toonaangevende neutronenverstrooiingsinstrumenten om te onderzoeken, op moleculair niveau, de fysieke veranderingen die onze celwanden ondergaan als ze in contact komen met gouden nanodeeltjes van verschillende lading.
Gouden nanodeeltjes met een diameter van 2 nm hadden ofwel kationische (positief geladen) of anionische (negatief geladen) groepen toegevoegd aan hun oppervlak. Om het celmembraan na te bootsen, het onderzoeksteam gebruikte twee dubbele lagen vette lipidemoleculen die 20-30 op elkaar werden gehouden en die samen de dynamische eigenschappen produceerden die te zien zijn in celmembranen. De wetenschappers pasten vervolgens neutronenreflectometrietechnieken toe op het ILL om de interactie tussen nanodeeltjes en celmembraan nauwkeurig te modelleren op een fractie van een nanometerschaal.
Wat ze ontdekten was dat de oppervlaktelading van nanodeeltjes inderdaad een belangrijke rol speelt bij het bepalen van hun interactie met onze celmembranen. Kationische nanodeeltjes gaan recht door het lipidemembraan en nestelen zich diep in de zwevende dubbellaag, de gehele membraanstructuur voldoende destabiliseren om de cel bij hogere concentraties volledig te vernietigen. In tegenstelling tot, anionische nanodeeltjes dringen helemaal niet door het lipidemembraan. Liever, bij bepaalde concentraties belemmeren ze de afbraak van het membraan, waardoor het bestand is tegen het soort extreme omstandigheden, zoals een verhoogde pH, dat zou het normaal gesproken aanzienlijk destabiliseren.
 Het instorten van het West-Antarctische ijs kan worden voorkomen door oceaanwater erop te laten sneeuwen
Het instorten van het West-Antarctische ijs kan worden voorkomen door oceaanwater erop te laten sneeuwen NASA volgt bosbranden van bovenaf om brandweerlieden beneden te helpen
NASA volgt bosbranden van bovenaf om brandweerlieden beneden te helpen Grondwateraanvullingspercentages in kaart gebracht voor Afrika
Grondwateraanvullingspercentages in kaart gebracht voor Afrika Voor als de chips op zijn - het behoud van de microbiële biodiversiteit van de Britse bodem voor de landbouw
Voor als de chips op zijn - het behoud van de microbiële biodiversiteit van de Britse bodem voor de landbouw Toerisme voornamelijk verantwoordelijk voor zwerfvuil op mediterrane stranden
Toerisme voornamelijk verantwoordelijk voor zwerfvuil op mediterrane stranden
Hoofdlijnen
- Oncogene: wat is het? & Hoe beïnvloedt het de celcyclus?
- Neushoornstroper krijgt 20 jaar cel in Zuid-Afrika
- Chloroplast: definitie, structuur en functie (met diagram)
- Een JELL-O-model van een diercel maken
- Zijn kleine populieren de toekomst van biobrandstoffen? Studies zeggen ja
- Anti-verouderingsbehandelingen - de wetenschap van het leven langer
- De beste manieren om bacteriën te kweken op agar
- Muizen helpen bij het vinden van gen voor slechte adem
- Het gebruik van glowsticks in vallen verhoogt de vangst van amfibieën in studie aanzienlijk
- Hoge performantie, flexibel, transparante krachtaanraaksensor voor draagbare apparaten
- Kan magnetisme ons helpen de hersenen te beheersen, van een afstand?

- Chemici zoeken ultramoderne lithium-zwavelbatterijen

- Ultrasnel, on-chip PCR zou de diagnose tijdens pandemieën kunnen versnellen

- Onderzoekers ontwikkelen een van 's werelds kleinste elektronische circuits

 Goedkoop, efficiënte en stabiele foto-elektrode kan de watersplitsing met zonne-energie verbeteren
Goedkoop, efficiënte en stabiele foto-elektrode kan de watersplitsing met zonne-energie verbeteren Wetenschappers ontdekken nieuwe architectuur in maïs
Wetenschappers ontdekken nieuwe architectuur in maïs Een mechanisme voor het ontwerpen van legeringen met hoge entropie met verbeterde magnetische eigenschappen
Een mechanisme voor het ontwerpen van legeringen met hoge entropie met verbeterde magnetische eigenschappen Indiase satellietvernietiging creëert puinveld van ruimteafval
Indiase satellietvernietiging creëert puinveld van ruimteafval Leveranciers in Zuid-Californië leren zich aan te passen aan vertragingen in satellietbestellingen
Leveranciers in Zuid-Californië leren zich aan te passen aan vertragingen in satellietbestellingen Opkomst en ondergang van waterblaren bieden een glimp onder de dikke ijskap van Groenland
Opkomst en ondergang van waterblaren bieden een glimp onder de dikke ijskap van Groenland Lijst met mineralen gevonden onder het zeebed
Lijst met mineralen gevonden onder het zeebed  Incident op Mauritius was 's werelds eerste grote lekkage van stookolie met een zeer laag zwavelgehalte
Incident op Mauritius was 's werelds eerste grote lekkage van stookolie met een zeer laag zwavelgehalte
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- Italian | Spanish | Portuguese | Swedish | Dutch | Danish | Norway | French | German |

-
Wetenschap © https://nl.scienceaq.com

