
Wetenschap
Wat betekent valentie in de wetenschap?
Belangrijke punten om te begrijpen over valentie:
Elektronenconfiguratie:Valentie verwijst specifiek naar de elektronen in de buitenste schil (valentieschil) van een atoom. Deze valentie-elektronen zijn het meest energetisch en betrokken bij chemische reacties.
Combinerende capaciteit:De valentie van een atoom bepaalt zijn combinerende capaciteit, wat het aantal chemische bindingen is dat het kan vormen. Een atoom met een valentie van 1 kan bijvoorbeeld één chemische binding vormen, terwijl een atoom met een valentie van 2 twee chemische bindingen kan vormen.
Elektronenwinst of -verlies:Atomen kunnen stabiliteit bereiken door elektronen te winnen of te verliezen totdat ze een volledige buitenste schil hebben. Deze neiging om elektronen te winnen of te verliezen wordt bepaald door hun valentie.
Elektronen delen:Bij covalente binding delen atomen valentie-elektronen om hun buitenste schillen te voltooien en stabiele moleculen te vormen. Het aantal gedeelde valentie-elektronen bepaalt de sterkte en het type chemische bindingen.
Periodieke trends:Valence volgt bepaalde trends in het periodiek systeem. Over het algemeen hebben elementen in dezelfde groep (verticale kolom) dezelfde valentie. Elementen in groepen 1 en 2 (alkalimetalen en aardalkalimetalen) hebben de neiging elektronen te verliezen, terwijl elementen in groepen 16 en 17 (chalcogenen en halogenen) de neiging hebben elektronen te winnen.
Uitzonderingen en speciale gevallen:Er zijn uitzonderingen en variaties in de valentie van sommige elementen, vooral bij overgangsmetalen. Overgangsmetalen kunnen meerdere oxidatietoestanden vertonen, wat betekent dat ze verschillende valenties kunnen hebben in verschillende chemische verbindingen.
Samenvattend is valentie een cruciaal concept in de scheikunde dat het combinatievermogen van een atoom betekent en de neiging ervan om valentie-elektronen te winnen, te verliezen of te delen om een stabiele elektronenconfiguratie te bereiken. Het begrijpen van valentie is essentieel voor het voorspellen van chemisch gedrag, het vormen van chemische bindingen en het analyseren van moleculaire structuren.
 Cementhydratatie visualiseren op moleculair niveau
Cementhydratatie visualiseren op moleculair niveau Verschil tussen grijs en wit gietijzer
Verschil tussen grijs en wit gietijzer Membraan kan afvalwater beter behandelen, waardevolle bronnen terugwinnen
Membraan kan afvalwater beter behandelen, waardevolle bronnen terugwinnen Als tafelzout oplost in water, is dat dan een fysische of chemische eigenschap?
Als tafelzout oplost in water, is dat dan een fysische of chemische eigenschap?  Een hoogefficiënte fotokatalysator voor het omzetten van koolstofdioxide in milieuvriendelijke energie met behulp van zonlicht
Een hoogefficiënte fotokatalysator voor het omzetten van koolstofdioxide in milieuvriendelijke energie met behulp van zonlicht
 Hoe klimaatverandering de foerageerpatronen van prehistorische mensen in Indonesië beïnvloedde
Hoe klimaatverandering de foerageerpatronen van prehistorische mensen in Indonesië beïnvloedde 200 vermist omdat vulkaan Guatemala nieuwe uitbarstingen bedreigt
200 vermist omdat vulkaan Guatemala nieuwe uitbarstingen bedreigt Schade door kanjer-orkanen die om vele redenen toenemen
Schade door kanjer-orkanen die om vele redenen toenemen Noord-Atlantisch klimaat veel voorspelbaarder na grote wetenschappelijke doorbraak
Noord-Atlantisch klimaat veel voorspelbaarder na grote wetenschappelijke doorbraak Hoe het aanpakken van invasieve soorten op het land tot 'verbluffende' verbeteringen op zee kan leiden
Hoe het aanpakken van invasieve soorten op het land tot 'verbluffende' verbeteringen op zee kan leiden
Hoofdlijnen
- Hoe lijken klonen op eeneiige tweelingen?
- Een wetenschapper maakt een afbeelding van alle chromosomen. Welke techniek gebruikt ze?
- Genetische aandoeningen: definitie, oorzaken, lijst met zeldzame en veel voorkomende ziekten
- Genetisch onderzoek van bloemkool onthult zijn evolutionaire geschiedenis
- Botsing van de rivierkreeft:waarom Amerikanen winnen
- Hoe het menselijk geheugen werkt
- Hoe status aan genen kleeft
- Zou jij een mier vertrouwen om je ledemaat te amputeren? De wetenschap laat zien dat ze bekwame chirurgen zijn
- Waarom het belangrijk is om parasieten te redden
- De toekomst van kleinschalige mijnbouwactiviteiten beïnvloeden

- NASA analyseerde de kracht van de tropische storm Fernands vóór de aanlanding

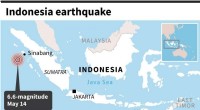
- Een aardbeving met een kracht van 6,6 op de schaal van Richter treft Sumatra in Indonesië:USGS
- Visdoden en ondrinkbaar water:dit is wat je deze zomer kunt verwachten voor de Murray Darling
- NASA aan je tafel:waar voedsel methaan ontmoet

 Hoe draagt Airbnb bij aan het uitstralen van het imago van toeristische bestemmingen?
Hoe draagt Airbnb bij aan het uitstralen van het imago van toeristische bestemmingen?  Oud DNA is een krachtig hulpmiddel om het verleden te bestuderen - wanneer archeologen en genetici samenwerken
Oud DNA is een krachtig hulpmiddel om het verleden te bestuderen - wanneer archeologen en genetici samenwerken Inosine zou een mogelijke route kunnen zijn naar het eerste RNA en de oorsprong van het leven op aarde
Inosine zou een mogelijke route kunnen zijn naar het eerste RNA en de oorsprong van het leven op aarde Krantenketen McClatchy vraagt faillissementsbescherming aan (update)
Krantenketen McClatchy vraagt faillissementsbescherming aan (update) Hoe werkt een dieselinspuitpomp?
Hoe werkt een dieselinspuitpomp?  Stadia van de ontwikkeling van kakkerlakken
Stadia van de ontwikkeling van kakkerlakken Uit welke componenten bestaat een ATP-molecuul?
Uit welke componenten bestaat een ATP-molecuul?  Hoe kaviaar werkt
Hoe kaviaar werkt
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

