
Wetenschap
Hoeveel sneller beweegt helium dan Argon?
* Temperatuurafhankelijkheid: De snelheid van gasmoleculen is direct gerelateerd aan hun temperatuur. Hoe heter het gas, hoe sneller de moleculen bewegen. Om helium en argon te vergelijken, moeten we de temperatuur kennen.
* Gemiddelde snelheid versus individuele snelheid: Gasmoleculen bewegen met een bereik van snelheden. We praten meestal over de * gemiddelde * snelheid van de moleculen. Zelfs bij dezelfde temperatuur zullen heliummoleculen een hogere gemiddelde snelheid hebben dan argonmoleculen.
* root-mean-square snelheid: Een gebruikelijke manier om de gemiddelde snelheid van gasmoleculen te meten is de "wortelgemiddelde snelheid" (RMS-snelheid). Het wordt berekend met behulp van de volgende formule:
`` `
v_rms =√ (3rt/m)
`` `
waar:
* V_RMS is de root-mean-square snelheid
* R is de ideale gasconstante
* T is de temperatuur in Kelvin
* M is de molaire massa van het gas
Hoe helium sneller is:
* Lagere molaire massa: Helium heeft een veel lagere molaire massa dan argon (4 g/mol versus 40 g/mol). Dit betekent dat bij dezelfde temperatuur heliummoleculen sneller zullen bewegen.
* Voorbeeld: Laten we zeggen dat we helium en argon hebben op 298 K (25 ° C). Als we deze waarden aansluiten op de bovenstaande formule, krijgen we:
* v_rms (he) =√ (3 * 8.314 j/mol · k * 298 k/0.004 kg/mol) ≈ 1352 m/s
* v_rms (ar) =√ (3 * 8.314 j/mol · k * 298 k/0,04 kg/mol) ≈ 431 m/s
Dit laat zien dat heliummoleculen ongeveer 3 keer sneller bewegen dan argonmoleculen bij kamertemperatuur.
Conclusie: Helium beweegt sneller dan argon bij dezelfde temperatuur omdat het een veel lagere molaire massa heeft.
 Burger King pakt klimaatverandering aan door het dieet van koeien te veranderen
Burger King pakt klimaatverandering aan door het dieet van koeien te veranderen Modelleringsstrategie stelt wetenschappers in staat om manieren te onderzoeken om opwarming te beperken, bijwerkingen verminderen
Modelleringsstrategie stelt wetenschappers in staat om manieren te onderzoeken om opwarming te beperken, bijwerkingen verminderen Mensen veranderen al minstens 45 jaar tropische bossen, 000 jaar
Mensen veranderen al minstens 45 jaar tropische bossen, 000 jaar Wat is het sterkste metaal op aarde?
Wat is het sterkste metaal op aarde?  Duizenden vluchten terwijl de cycloon richting Bangladesh trekt
Duizenden vluchten terwijl de cycloon richting Bangladesh trekt
Hoofdlijnen
- Wat kan wetenschap niet studeren?
- Wat is de definitie van diafragma in samengestelde microscoop?
- Wat betekent het woordafhankelijke variabele in de wetenschap?
- Waarom zijn de roze meren van Australië roze?
- Een andere naam voor een heterotrof is?
- Wat is het proces waarbij receptorcellen in de huid de ene vorm van energie transformeren naar de andere die wordt genoemd?
- Wat zijn vrije nucleotiden?
- Wat is het bewijs voor macro -evolutie?
- Wetenschappers tonen aan dat positief geladen hydrogels de overleving en groei van neurale stamcellen bevorderen
- Optische frequentiekam biedt een handige manier om ongrijpbare terahertz-frequenties te genereren

- Een nieuwe raaklijn nemen om vervelende golven in fusieplasma's te beheersen

- Zeer heldere bron van coherent licht van UV tot THz

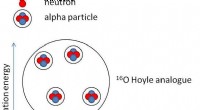
- Bestaan er condensaten van alfadeeltjes in zuurstofkernen?
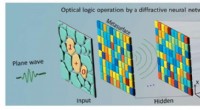
- Optische logische bewerkingen uitvoeren door een diffractief neuraal netwerk
 Japanse zeldzame-aardetransport wekt hoop op het verminderen van China's afhankelijkheid
Japanse zeldzame-aardetransport wekt hoop op het verminderen van China's afhankelijkheid Nieuw-Zeelandse gletsjers krimpen
Nieuw-Zeelandse gletsjers krimpen Wat is om gas te persen in een kleinere ruimte die wordt genoemd?
Wat is om gas te persen in een kleinere ruimte die wordt genoemd?  Hoe worden de studieobjecten genoemd?
Hoe worden de studieobjecten genoemd?  U gebruikt al elke dag heuristieken. Dit is wat ze zijn
U gebruikt al elke dag heuristieken. Dit is wat ze zijn  Tiny Patch kan helpen bij het opsporen van besmet voedsel
Tiny Patch kan helpen bij het opsporen van besmet voedsel  Cysteïnesynthese was een belangrijke stap in het ontstaan van leven:studie
Cysteïnesynthese was een belangrijke stap in het ontstaan van leven:studie China zegt dat de Mars-sonde stabiel is; geen woord over herbruikbaar ruimtevaartuig
China zegt dat de Mars-sonde stabiel is; geen woord over herbruikbaar ruimtevaartuig
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

