
Wetenschap
Waarom is er een toename van de grootte van atomen terwijl u periodieke tafelkast inert gassen naar beneden gaat?
1. Toenemend aantal elektronenschalen:
* Terwijl u het periodieke tabel naar beneden gaat, krijgt elk opeenvolgende element een extra elektronenschil. Deze schelpen bevinden zich verder weg van de kern.
* Zie het alsof je meer lagen aan een ui toevoegt - de buitenste laag ligt verder van het midden.
2. Afschermingseffect:
* De binnenste elektronenschillen (dichter bij de kern) beschermen de buitenste elektronen tegen de volledige positieve lading van de kern.
* Dit afschermingseffect verzwakt de aantrekkingskracht tussen de kern en de buitenste elektronen, waardoor ze gemakkelijker te verwijderen zijn en de atomaire straal toestaat.
3. Zwakke nucleaire aantrekkingskracht:
* Naarmate het aantal elektronenschalen toeneemt, wordt de positieve lading van de kern verspreid over een groter volume. Dit vermindert de sterkte van de aantrekkingskracht tussen de kern en de buitenste elektronen.
inerte gassen (edelgassen)
* Inerte gassen hebben een volledige buitenste schaal van elektronen, waardoor ze uitzonderlijk stabiel en niet -reactief worden.
* De toename van de atoomgrootte is nog steeds aanwezig in inerte gassen omdat dezelfde factoren (meer elektronenschalen, afscherming) spelen.
Voorbeeld:
* Helium (hij) is het kleinste inerte gas, met slechts één elektronenschil.
* Radon (RN) is het grootste inert gas, met zeven elektronenschalen.
Laat het me weten als je nog andere vragen hebt!
 Is een koolhydraat anorganisch of organisch?
Is een koolhydraat anorganisch of organisch?  Gassen kunnen worden geplet, gecomprimeerde, maar niet kunnen dat niet?
Gassen kunnen worden geplet, gecomprimeerde, maar niet kunnen dat niet?  Een nieuwe methode zou de verspilling bij de productie van medicijnen kunnen terugdringen
Een nieuwe methode zou de verspilling bij de productie van medicijnen kunnen terugdringen  Wat is het percentage samenstelling van MNCL2?
Wat is het percentage samenstelling van MNCL2?  Nieuwe zilveren holle vezel verhoogt de elektroreductie van CO2
Nieuwe zilveren holle vezel verhoogt de elektroreductie van CO2
Hoofdlijnen
- Wat was er eerst:sociale dominantie of grote hersenen? Wespen kunnen het vertellen
- Welke tak van de wetenschap doet botanicus?
- Waarom spelen mannelijke kuikens meer dan vrouwtjes? Studie vindt antwoorden in verre voorouders
- Science Fair Project Ideas: Equine
- Hoe sociaal contact met zieke mieren hun nestgenoten beschermt
- Hoe verhoudt het metabolisme zich tot enzymen?
- Wat is het estuarium in organismen?
- Wat is BCG Matrix?
- Waarom is DNA de blauwdruk van het leven?
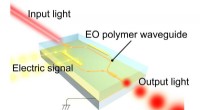
- Demonstratie van een zeer efficiënte modulator met behulp van een organisch elektro-optisch polymeer voor zichtbaar licht
- Onderzoekers gebruiken ionenversnelling om reactorachtige omstandigheden in metaallegeringen te simuleren

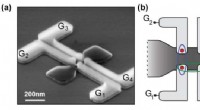
- Kwantumtechnologie gebruiken om nieuwe deeltjes te beperken

- Belangrijke mijlpaal in de totstandkoming van een kwantumcomputer
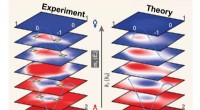
- Wetenschappers onthullen eerste kwantumsimulatie van 3D-topologische materie met ultrakoude atomen
 Hoe dragen energiecentrales bij aan de opwarming van de aarde?
Hoe dragen energiecentrales bij aan de opwarming van de aarde?  Dieren en planten die op bergen leven
Dieren en planten die op bergen leven Hoeveel elementen zitten er in koperfosfaat?
Hoeveel elementen zitten er in koperfosfaat?  Wat zijn de vijf meest voorkomende elementen op aarde?
Wat zijn de vijf meest voorkomende elementen op aarde?  Hoe een beleid om grondwatertekorten aan te pakken onbedoeld de luchtvervuiling in Noord-India verhoogde
Hoe een beleid om grondwatertekorten aan te pakken onbedoeld de luchtvervuiling in Noord-India verhoogde  Overstromingen langs de kust van Bay Area veroorzaken regionale verstoringen van woon-werkverkeer
Overstromingen langs de kust van Bay Area veroorzaken regionale verstoringen van woon-werkverkeer Gebroken glas:nieuwe theorie legt uit hoe dingen breken
Gebroken glas:nieuwe theorie legt uit hoe dingen breken  Lost verdund zoutzuur koper op?
Lost verdund zoutzuur koper op?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

