
Wetenschap
Waarom is de tetraëdrische hoek 109.5?
1. De tetraëder:
* Een tetraëder is een geometrische vorm met vier driehoekige gezichten en vier hoekpunten.
* In een reguliere tetraëder zijn alle vier gezichten gelijkzijdige driehoeken en zijn alle bindingshoeken gelijk.
2. De ruimte maximaliseren:
* Stel je vier identieke atomen of groepen voor die zijn bevestigd aan een centraal atoom.
* Vanwege elektronenafstoting zullen deze groepen proberen zichzelf zo ver mogelijk van elkaar te positioneren om elektrostatische interacties te minimaliseren.
* De tetraëdrische geometrie biedt de meest efficiënte manier om vier groepen rond een centraal atoom te rangschikken, waardoor de afstand ertussen wordt gemaximaliseerd.
3. Afleiding:
* vSEPR -theorie: De theorie van de valentieschaal elektronenparen (VSEPR) verklaart de vorm van moleculen op basis van de afstoting tussen elektronenparen rond een centraal atoom.
* Ideale tetraëdrische hoek: In een ideale tetraëder is de hoek tussen twee hoekpunten ongeveer 109,47 °. Deze hoek is het gevolg van de geometrie van de vorm en de principes van het maximaliseren van de ruimte.
* werkelijke hoek: In echte moleculen kan de werkelijke tetraëdrische hoek enigszins afwijken van 109,5 ° vanwege factoren zoals de grootte van de atomen of de aanwezigheid van eenzame paren elektronen.
Samenvattend:
De tetraëdrische hoek van 109,5 ° is het gevolg van de optimale opstelling van vier identieke atomen of groepen rond een centraal atoom, waardoor de afstand tussen hen als gevolg van elektronenafstoting wordt gemaximaliseerd. Deze geometrie minimaliseert elektrostatische interacties en leidt tot de stabiele, tetraëdrische vorm waargenomen in veel moleculen.
 Een nieuw regime voor het analyseren van eigenschappen van topologische materialen
Een nieuw regime voor het analyseren van eigenschappen van topologische materialen Wat is 0,40 mol natriumchloride in gram?
Wat is 0,40 mol natriumchloride in gram?  Röntgenbeeldvorming onthult inzichten in een natuurlijke mug-dodende verbinding
Röntgenbeeldvorming onthult inzichten in een natuurlijke mug-dodende verbinding Nieuwe MD-simulatie werpt licht op het mysterie van de structuur van gehydrateerde elektronen
Nieuwe MD-simulatie werpt licht op het mysterie van de structuur van gehydrateerde elektronen Waarom wordt ammoniakgas niet boven water opgevangen?
Waarom wordt ammoniakgas niet boven water opgevangen?
 Het warmste decennium van 2010 in de geschiedenis, VN zegt als de uitstoot weer stijgt
Het warmste decennium van 2010 in de geschiedenis, VN zegt als de uitstoot weer stijgt Sigarettenpeuken zijn de vergeten plasticvervuiling - en ze zouden onze planten kunnen doden
Sigarettenpeuken zijn de vergeten plasticvervuiling - en ze zouden onze planten kunnen doden Feiten over witte eiken bomen
Feiten over witte eiken bomen  Welke evolutietheorie ontwikkelde Lamarck in 1809?
Welke evolutietheorie ontwikkelde Lamarck in 1809?  Nieuwe methode meet zeldzame sporen van een vluchtig gas
Nieuwe methode meet zeldzame sporen van een vluchtig gas
Hoofdlijnen
- Wat zijn kenmerken van het leven die aangetoond zijn in cellulaire ademhaling?
- De persoonlijke beschermingsmiddelen die tijdens de COVID-19-pandemie worden gebruikt, raken verstrikt in wilde dieren
- Welke beschrijft het beste dat mRNA in een cel wordt geproduceerd?
- Welke enzymen zijn verantwoordelijk voor de afbraak van zetmeel?
- Hoe dient de combinatie van bases als een patroon of code voor het produceren van exacte chromosoomkopieën tijdens celdeling?
- Wat zou er gebeuren als de kern nooit zou bestaan?
- Waar staat PCT voor in de biologie?
- Wat is patroonvorming?
- Wat is de rol van glucose in het lichaam?
- De kleinste microgrijper, gekweekt op optische vezels, wordt op afstand bediend met licht

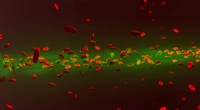
- Door optische kracht geïnduceerd zelfgeleidend licht in suspensies van menselijke rode bloedcellen
- Nieuw ontwerp kan glasvezelcommunicatie energiezuiniger maken

- Continuous Electron Beam Accelerator Facility levert tegelijkertijd een straal aan alle vier de experimentele gebieden

- Natuurkundigen ontdekken aanwijzingen voor het mechanisme achter magnetische herverbinding
 Hoe visvinnen evolueerden vlak voor de overgang naar land
Hoe visvinnen evolueerden vlak voor de overgang naar land  Een vulkaan bouwen voor een parade Float
Een vulkaan bouwen voor een parade Float Voordat u in cryptovaluta investeert, Lees dit
Voordat u in cryptovaluta investeert, Lees dit Wat is het verschil tussen potentiaal en kinetische energie in een VEN -diagram?
Wat is het verschil tussen potentiaal en kinetische energie in een VEN -diagram?  Hoeveel atomen in de formule FES?
Hoeveel atomen in de formule FES?  Wat is de term die wordt gebruikt voor vuil gesteente onder oppervlaktebodem en grind?
Wat is de term die wordt gebruikt voor vuil gesteente onder oppervlaktebodem en grind?  Is wolk een vaste vloeistof of gas?
Is wolk een vaste vloeistof of gas?  Welke eigenschappen van een bal is geconserveerd als deze vrij in vacuüm valt?
Welke eigenschappen van een bal is geconserveerd als deze vrij in vacuüm valt?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

