
Wetenschap
Waarom vult een s orbitale vulling vóór een P -orbitaal?
* energieniveaus: S -orbitalen bevinden zich op een lager energieniveau dan p -orbitalen binnen dezelfde elektronenschil. Dit betekent dat een elektron in een orbitaal gemiddeld dichter bij de kern ligt en een sterkere aantrekkingskracht ervaart.
* Vorm: S-orbitalen zijn bolvormig, terwijl p-orbitalen halbellvormig zijn. Dit verschil in vorm beïnvloedt de ruimtelijke verdeling van elektronen en beïnvloedt hun energieniveaus.
* Regeling van elektronen-elektronen: Het s orbitaal is kleiner en compacter dan het p -orbitaal. Dit betekent dat de elektronen in een orbitale minder afstoting van elkaar ervaren, waardoor de s orbitaal een energetisch gunstiger locatie voor elektronen is.
Samenvatting:
De combinatie van lagere energieniveaus, kleinere grootte en minder elektron-elektronenafstoting in S-orbitalen vergeleken met P-orbitalen leidt tot het vullen van S-orbitalen vóór P-orbitalen. Dit principe is van fundamenteel belang om de elektronische configuratie van atomen en het gedrag van chemische elementen te begrijpen.
 Welke verbinding heeft waarschijnlijk geen ionische bindingen?
Welke verbinding heeft waarschijnlijk geen ionische bindingen?  Hoeveel covalente bindingen heeft koolstof nodig om de buitenste schil te creëren?
Hoeveel covalente bindingen heeft koolstof nodig om de buitenste schil te creëren?  Wat is een isotoop?
Wat is een isotoop?  Gecombineerde databenadering kan de ontwikkeling van nieuwe materialen versnellen
Gecombineerde databenadering kan de ontwikkeling van nieuwe materialen versnellen Nieuwe techniek ontwikkeld voor het meten van de temperatuurverdeling in een enkel katalysatordeeltje
Nieuwe techniek ontwikkeld voor het meten van de temperatuurverdeling in een enkel katalysatordeeltje
 Wat zit er in je water? Onderzoekers identificeren nieuwe giftige bijproducten van het desinfecteren van drinkwater
Wat zit er in je water? Onderzoekers identificeren nieuwe giftige bijproducten van het desinfecteren van drinkwater Welke soorten weersomstandigheden doet Texas?
Welke soorten weersomstandigheden doet Texas?  Gletsjer nieuwste Amerikaanse park wordt verschroeid door westerse bosbranden
Gletsjer nieuwste Amerikaanse park wordt verschroeid door westerse bosbranden De poolgebieden van de aarde communiceren via oceanische ansichtkaarten, sfeervolle sms-berichten
De poolgebieden van de aarde communiceren via oceanische ansichtkaarten, sfeervolle sms-berichten Hoe meer overstromingen als gevolg van klimaatverandering de waterwegen in de VS beïnvloeden
Hoe meer overstromingen als gevolg van klimaatverandering de waterwegen in de VS beïnvloeden
Hoofdlijnen
- Wat is het doel van anxiolytica?
- Simpele vetten en aminozuren om uit te leggen hoe het leven begon
- DNA-profilering lost puzzel op Australische konijnenplaag op
- Welke twee kenmerken hebben bacteriën zo lang op aarde geholpen?
- Ziekte van Lyme bij honden:wat hondeneigenaren moeten weten
- Hoe bedreigde zoetwaterparelmossel redden?
- Wat is een proces door welke cellen in structuur veranderen?
- Neteldieren controleren bacteriën op afstand
- Wetenschapsprojecten over Dominant en Recessieve Genen
- Camera legt microscopisch kleine hologrammen vast met snelheden van femtoseconden

- Natuurkundigen maken de eerste resultaten van de definitieve dataset van Daya Bays bekend

- CSI Solid-State:de vingerafdrukken van kwantumeffecten
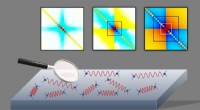
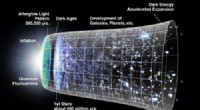
- Onderzoekers vinden nieuwe manier om de nagloed van de oerknal te verkennen
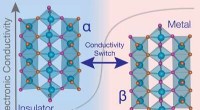
- Nieuw materiaal schakelt tussen elektrisch geleidende en isolerende toestanden
 VS sluit de watervoorziening voor sommige staten, Mexico als de droogte toeslaat
VS sluit de watervoorziening voor sommige staten, Mexico als de droogte toeslaat Wat moet u doen als u of iemand weet dat deze het doelwit is van deepfake-porno-AI-naakten
Wat moet u doen als u of iemand weet dat deze het doelwit is van deepfake-porno-AI-naakten  Welk type reactie treedt op wanneer zwavelzuur reageert met een alkaline?
Welk type reactie treedt op wanneer zwavelzuur reageert met een alkaline?  Nieuwe biochemische route die meer veerkrachtige gewasvariëteiten kan ontwikkelen
Nieuwe biochemische route die meer veerkrachtige gewasvariëteiten kan ontwikkelen Waarom explodeert soda in vriezers?
Waarom explodeert soda in vriezers?  Dikke rook boven Athene terwijl buitenwijken bosbranden bestrijden
Dikke rook boven Athene terwijl buitenwijken bosbranden bestrijden Tarwe en bankgras kunnen giftige metalen uit verontreinigde grond halen
Tarwe en bankgras kunnen giftige metalen uit verontreinigde grond halen Wetenschappers hebben een revolutionaire manier bedacht om de kilogram te herdefiniëren
Wetenschappers hebben een revolutionaire manier bedacht om de kilogram te herdefiniëren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

