
Wetenschap
Hebben de elementen in het periodieke tabel dezelfde massa?
Dit is waarom:
* Atomisch nummer: Elk element wordt gedefinieerd door het atoomnummer, dat het aantal protonen in zijn kern weergeeft.
* protonen en neutronen: Protonen en neutronen vormen bijna alle massa van een atoom.
* isotopen: De meeste elementen hebben isotopen, die atomen van hetzelfde element zijn met verschillende aantallen neutronen. Dit betekent dat hun atoommassa's kunnen variëren.
Voorbeeld:
* koolstof Heeft een atoomnummer van 6, wat betekent dat het altijd 6 protonen heeft.
* carbon-12 heeft 6 neutronen, waardoor de atoommassa 12 wordt.
* carbon-14 heeft 8 neutronen, die zijn atoommassa maakt 14.
Conclusie:
Het periodiek systeem geeft een overzicht van de gemiddelde atoommassa van elk element, rekening houdend met de natuurlijke overvloed van zijn isotopen. Hoewel elementen hetzelfde aantal protonen delen, kunnen hun massa's variëren vanwege de aanwezigheid van isotopen.
 Waarom zou het toevoegen van HCL aan zuiver water het omzetten in een zuur?
Waarom zou het toevoegen van HCL aan zuiver water het omzetten in een zuur?  Direct schrijven met inkt op cellulosestructuren met hoge resolutie
Direct schrijven met inkt op cellulosestructuren met hoge resolutie  Hoe worden chemische reacties beschreven?
Hoe worden chemische reacties beschreven?  Wat was het element dat werd gebruikt als een doelsubstantie in experimenten door Irene Joliot Curie?
Wat was het element dat werd gebruikt als een doelsubstantie in experimenten door Irene Joliot Curie?  Een strategie om de efficiëntie van koper-indium-galliumselenide-zonnecellen verder te vergroten
Een strategie om de efficiëntie van koper-indium-galliumselenide-zonnecellen verder te vergroten
 Wegen en ontbossing exploderen in het Congobekken
Wegen en ontbossing exploderen in het Congobekken Dispositie beïnvloedt hoe falen wordt gevoeld
Dispositie beïnvloedt hoe falen wordt gevoeld  Uit veldexperimenten blijkt dat hoefdieren net zo bang zijn voor olifanten als luipaarden
Uit veldexperimenten blijkt dat hoefdieren net zo bang zijn voor olifanten als luipaarden  De oceanen in kaart brengen onzichtbare helden, één microbe tegelijk
De oceanen in kaart brengen onzichtbare helden, één microbe tegelijk Er zijn veranderingen nodig om de waterinfrastructuur in de VS te financieren
Er zijn veranderingen nodig om de waterinfrastructuur in de VS te financieren
Hoofdlijnen
- Wat zijn de drie soorten meercellige algen?
- Wat zijn genetische vergelijkingen?
- Wat zijn wierook en mirre?
- Hoe malariaparasieten bestand zijn tegen de hitte van koorts
- Kunnen algen die 'arme leveranciers' zijn, koralen helpen terugkomen na het bleken?
- In het laboratorium gekweekte hersenorganoïden slimmer maken
- Plastic-kaslandbouw:een nieuw bodemprofielontwerp voor mondiale duurzaamheid en verbeterde gewasproductie
- Een flitsende gele keelzanger? Daar zijn genen voor
- Uit onderzoek blijkt dat eiwitten een sleutelrol spelen bij het helpen van cilium om signalen naar de rest van de cel over te brengen
- Vloeistofdynamiek geeft inzicht in natuurbrandgedrag

- Vloeistoffen krijgen glans door terahertz-straling
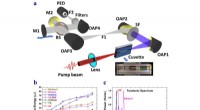
- De koudste temperatuur van vloeibaar water en de bijzonderheid ervan vinden

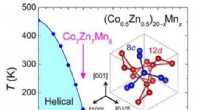
- Ongeordende skyrmion-fase gestabiliseerd door magnetische frustratie in een chirale magneet
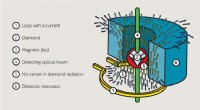
- Natuurkundigen ontwerpen nieuwe antenne voor supergevoelige magnetometers van de volgende generatie
 Wat is 36.8 in Fahrenheit?
Wat is 36.8 in Fahrenheit?  Britse politie vindt vermiste Britten sneller in binnen- of buitenland.
Britse politie vindt vermiste Britten sneller in binnen- of buitenland. Chemici hebben verbindingen gemaakt die glaucoom kunnen behandelen
Chemici hebben verbindingen gemaakt die glaucoom kunnen behandelen Welke dieren kauwen boomtakken af?
Welke dieren kauwen boomtakken af?  Op weg naar een nieuw snelheidsrecord in de Kalahari
Op weg naar een nieuw snelheidsrecord in de Kalahari Instant messaging in eiwitten ontdekt
Instant messaging in eiwitten ontdekt Wat zijn de verschillende theorieën over de vorm van de aarde?
Wat zijn de verschillende theorieën over de vorm van de aarde?  Vroege carrière onderzoekers waarderen hun baan, maar er is ruimte voor verbetering
Vroege carrière onderzoekers waarderen hun baan, maar er is ruimte voor verbetering
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

