
Wetenschap
Waarom zijn waterstof en helium alleen op een rij op de periodiek systeem?
Hier is een uitsplitsing:
* waterstof: Waterstof heeft slechts één proton en één elektron. De elektronenconfiguratie is 1S¹. Het wordt op de eerste rij geplaatst omdat het maar één elektronenschil heeft. Hoewel het soms is gegroepeerd met alkali -metalen (groep 1) vanwege de neiging om zijn elektron te verliezen en een +1 -ion te vormen, vertoont het ook niet -metalen gedrag.
* helium: Helium heeft twee protonen en twee elektronen. De elektronenconfiguratie is 1S². Net als waterstof heeft het slechts één elektronenschil en plaatst deze op de eerste rij. Helium is een edelgas (groep 18), en het heeft een volledige buitenste schaal (1S²) waardoor het uiterst niet -reactief is.
Waarom ze gescheiden zijn:
* vullen van elektronenschalen: Het periodiek systeem is georganiseerd op basis van het vullen van elektronenschalen. Elementen in dezelfde rij (periode) hebben hetzelfde aantal elektronenschalen.
* Quantumnummers: De specifieke opstelling van elektronen in atomen wordt beschreven door kwantumnummers. Waterstof en helium hebben de laagst mogelijke waarden voor hun belangrijkste kwantumnummer (n =1), wat aangeeft dat ze slechts één elektronenschil hebben.
* Reactiviteit: Waterstof en helium hebben zeer verschillende reactiviteiten. Waterstof kan zowel ionische als covalente bindingen vormen, terwijl helium extreem inert is.
Samenvatting:
De plaatsing van waterstof en helium alleen in de eerste rij is een gevolg van hun unieke elektronische configuraties en de manier waarop elektronenschalen worden gevuld, wat hun chemische eigenschappen bepaalt. Hun unieke kenmerken onderscheiden ze ook van de andere elementen in het periodiek systeem.
 Is er in welke vorm dan ook water vaste gas of vloeistof op Uranus?
Is er in welke vorm dan ook water vaste gas of vloeistof op Uranus?  Wat kan worden bepaald met behulp van een chemische formule. A. de elementen waaruit de verbinding bestaat B. pH van de oplossing C. kookpunt D. stoffen oplossing?
Wat kan worden bepaald met behulp van een chemische formule. A. de elementen waaruit de verbinding bestaat B. pH van de oplossing C. kookpunt D. stoffen oplossing?  Video:Hoe meten we temperatuur?
Video:Hoe meten we temperatuur? Wetenschappers ontwikkelen snelle chemie die een nieuwe klasse polymeren ontsluit
Wetenschappers ontwikkelen snelle chemie die een nieuwe klasse polymeren ontsluit Wat is de polariteit van natriumbenzoaat?
Wat is de polariteit van natriumbenzoaat?
 Satellieten om de toestand van de zee te onthullen en veel meer dan het oog kan zien
Satellieten om de toestand van de zee te onthullen en veel meer dan het oog kan zien Dust Bowl zou de oogst van vandaag verwoesten, studie vondsten
Dust Bowl zou de oogst van vandaag verwoesten, studie vondsten Een nieuwe benadering om aardbevingsslipdistributies te berekenen
Een nieuwe benadering om aardbevingsslipdistributies te berekenen Hittestress escaleert in steden door opwarming van de aarde
Hittestress escaleert in steden door opwarming van de aarde De omvang van het poolijs aan het einde van de zomer is de achtste laagste ooit geregistreerd
De omvang van het poolijs aan het einde van de zomer is de achtste laagste ooit geregistreerd
Hoofdlijnen
- Wat is de rol als ATP -synthase in fotosynthese?
- Hoe cellen op de juiste manier reageren in barre omgevingen als gevolg van de opwarming van de aarde
- Waarom is het domein genaamd Archaea?
- Dolfijn uit Florida gevonden met hoogpathogene vogelgriep:rapport
- Hommels kunnen volgens de Californische instandhoudingswet als vissen worden geclassificeerd, zegt de rechtbank
- Nieuw zenuwdegeneratiemolecuul geïdentificeerd
- Kunnen mRNA-vaccins de veehouderij helpen stimuleren?
- Is Phrenology Science of Pseudo Science?
- Prioriteiten identificeren om slimme digitale technologieën te benutten voor duurzame gewasproductie
- Hoe röntgenstraling in materie genetische toxische laagenergetische elektronen creëert
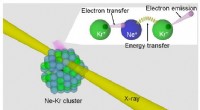
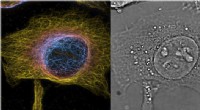
- Superresolutiemicroscopie in zowel ruimte als tijd
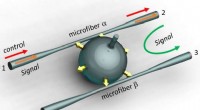
- Team ontwikkelt optisch gestuurde, niet-wederkerige multifunctionele fotonische apparaten
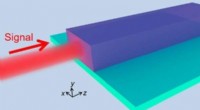
- Zwakte is goed... bij het beheersen van licht
- Wetenschappers ontwikkelen foto-emissie-elektronenmicroscopie bij omgevingsdruk

 Hoeveel mol zn worden er verbruikt als 1,60 x 1024 moleculen hcl volledig reageren in de volgende vergelijking plus 2hcl is gelijk aan zncl2 h2?
Hoeveel mol zn worden er verbruikt als 1,60 x 1024 moleculen hcl volledig reageren in de volgende vergelijking plus 2hcl is gelijk aan zncl2 h2?  Aardgaspijpleidingen onder druk zetten voor lekkagedetectie
Aardgaspijpleidingen onder druk zetten voor lekkagedetectie  Bestaat er prebiotisch materiaal in de ruimte?
Bestaat er prebiotisch materiaal in de ruimte?  Wordt herhaald en reproduceert hetzelfde woord?
Wordt herhaald en reproduceert hetzelfde woord?  Wat is een condensatiereactie?
Wat is een condensatiereactie?  Nucleic Acid Facts
Nucleic Acid Facts Voors en tegens van Recombinant DNA Technology
Voors en tegens van Recombinant DNA Technology Evenwichtsoefening:verbeterde waterbehandelingstechniek met behulp van energiematching
Evenwichtsoefening:verbeterde waterbehandelingstechniek met behulp van energiematching
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

