
Wetenschap
Wat gebeurt er als je een elektrische stroom door water laat lopen?
1. Dissociatie van water:
- Watermoleculen (H2O) bestaan uit twee waterstofatomen gebonden aan één zuurstofatoom.
- Wanneer een elektrische stroom wordt toegepast, dissociëren de watermoleculen in waterstof (H2) en zuurstof (O2) gassen via een proces dat elektrolyse wordt genoemd.
2. Vorming van waterstof en zuurstof:
- Waterstofgas (H2) wordt geproduceerd aan de kathode (negatieve elektrode), waar positief geladen waterstofionen (H+) elektronen opnemen en worden gereduceerd tot waterstofgasmoleculen.
- Zuurstofgas (O2) wordt geproduceerd aan de anode (positieve elektrode), waar negatief geladen hydroxide-ionen (OH-) elektronen verliezen en worden geoxideerd om zuurstofgasmoleculen te vormen.
3. Gasbellen:
- Terwijl waterstof- en zuurstofgassen worden geproduceerd, vormen ze zichtbare bellen die naar het wateroppervlak stijgen.
- De bellen bestaan uit pure waterstof- en zuurstofgassen, die kunnen worden opgevangen en gebruikt voor diverse toepassingen.
4. pH-veranderingen:
- Tijdens elektrolyse wordt het water nabij de kathode licht alkalisch door de ophoping van hydroxide-ionen (OH-), terwijl het water nabij de anode licht zuur wordt door de vorming van waterstofionen (H+).
5. Chemische reacties:
- Elektrolyse kan ook andere chemische reacties in het water vergemakkelijken. Opgeloste mineralen, zouten en onzuiverheden in het water kunnen reageren met de geproduceerde waterstof- en zuurstofgassen, waardoor nieuwe verbindingen of stoffen ontstaan.
6. Elektrolyten:
- Zuiver water is een slechte geleider van elektriciteit, maar de aanwezigheid van opgeloste zouten, zuren of basen in het water zorgt ervoor dat de elektrische stroom gemakkelijker kan stromen. Deze stoffen staan bekend als elektrolyten.
7. Corrosie:
- De elektroden die bij elektrolyse worden gebruikt, kunnen corrosie ondergaan als gevolg van de chemische reacties en oxidatiereductieprocessen die optreden tijdens elektrolyse.
Het is belangrijk op te merken dat de specifieke reacties en resultaten tijdens elektrolyse kunnen variëren, afhankelijk van de waterkwaliteit, opgeloste stoffen, elektrodematerialen en andere experimentele omstandigheden.
 Wat is de vergelijking voor de neutralisatie van zoutzuur en fenolftaleïne?
Wat is de vergelijking voor de neutralisatie van zoutzuur en fenolftaleïne?  Bevat een waterhoudende verbinding water?
Bevat een waterhoudende verbinding water?  Wat gebeurt er als u zwembadchloor mengt en vloeistof breekt?
Wat gebeurt er als u zwembadchloor mengt en vloeistof breekt?  Doorbraak in de medicamenteuze chemie kan leiden tot betere geneesmiddelen
Doorbraak in de medicamenteuze chemie kan leiden tot betere geneesmiddelen Onderzoekers maken nieuw laagsmeltend, stikstofhoudend, tinachtig chloorfosfaatglas
Onderzoekers maken nieuw laagsmeltend, stikstofhoudend, tinachtig chloorfosfaatglas
 Wat er nodig is om bosbranden te blussen
Wat er nodig is om bosbranden te blussen Eens in je leven overstromingen worden tegen het einde van de eeuw een normaal verschijnsel
Eens in je leven overstromingen worden tegen het einde van de eeuw een normaal verschijnsel Acute armoede treft de Ghanese savanneregio:hoe oliezaden de lokale diëten kunnen helpen stimuleren
Acute armoede treft de Ghanese savanneregio:hoe oliezaden de lokale diëten kunnen helpen stimuleren  Zombiestorm Leslie raast Portugal binnen
Zombiestorm Leslie raast Portugal binnen Wat veroorzaakt de verwoestende overstromingen in China, India en Bangladesh?
Wat veroorzaakt de verwoestende overstromingen in China, India en Bangladesh?
Hoofdlijnen
- Hoe je hersenen werken
- Eencellig onderzoek belicht de rol van DNA-methylatie bij beslissingen over het lot van cellen
- Hoe klimaatverandering planten onder druk zet en hun groei verandert
- Hoe onderzoekers de zaadproductie voor nieuwe tarwe versnellen
- Een dier trainen? Een ethicus legt uit hoe en waarom jouw hond, maar niet de kikker, gestraft kan worden
- Hoe overleef je een massale uitsterving?
- Onderzoekers bepalen hoe groepen beslissingen nemen
- Historische tekens in het landschap:onderzoek naar de praktijk van knotten in West-Noorwegen
- Australische politie jaagt op moordenaar van gigantische krokodil
- Zelf-geassembleerde optische holtes kunnen een sterke koppelingstoestand bereiken die polaritonvorming ondersteunt
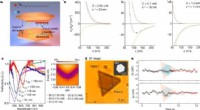
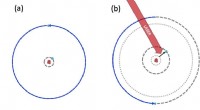
- Onderzoek bereikt de optisch coherente manipulatie van cirkelvormige Rydberg-toestanden
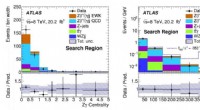
- ATLAS-experiment zoekt nieuw inzicht in het standaardmodel
- Wetenschappers een stap dichter bij een klok die GPS en Galileo zou kunnen vervangen

- Een nieuwe manier om vlamvertrager in een lithium-ionbatterij te plaatsen
 Tropische cycloon Son-Tinh komt aan land en NASA onderzoekt het spoor van regenval
Tropische cycloon Son-Tinh komt aan land en NASA onderzoekt het spoor van regenval Zones voor Redwoods
Zones voor Redwoods  Wat is Tyvek?
Wat is Tyvek?  Synthese van TNTNB vertegenwoordigt nieuwe energiepiek voor organische explosieven
Synthese van TNTNB vertegenwoordigt nieuwe energiepiek voor organische explosieven Zee-egels op bestelling gemaakt:wetenschappers maken transgene doorbraak
Zee-egels op bestelling gemaakt:wetenschappers maken transgene doorbraak  Rapport schetst groeiende klimaatveranderingsgerelateerde bedreigingen voor het gebied van de Grote Meren
Rapport schetst groeiende klimaatveranderingsgerelateerde bedreigingen voor het gebied van de Grote Meren New York neemt maatregelen tegen overstromingen terwijl storm de Amerikaanse oostkust beukt
New York neemt maatregelen tegen overstromingen terwijl storm de Amerikaanse oostkust beukt Verhogen deze retail-apps de klantbetrokkenheid en omzet in alle kanalen?
Verhogen deze retail-apps de klantbetrokkenheid en omzet in alle kanalen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

