
Wetenschap
3D bioprint, gevasculariseerde proximale tubuli bootsen de reabsorptiefuncties van de menselijke nieren na
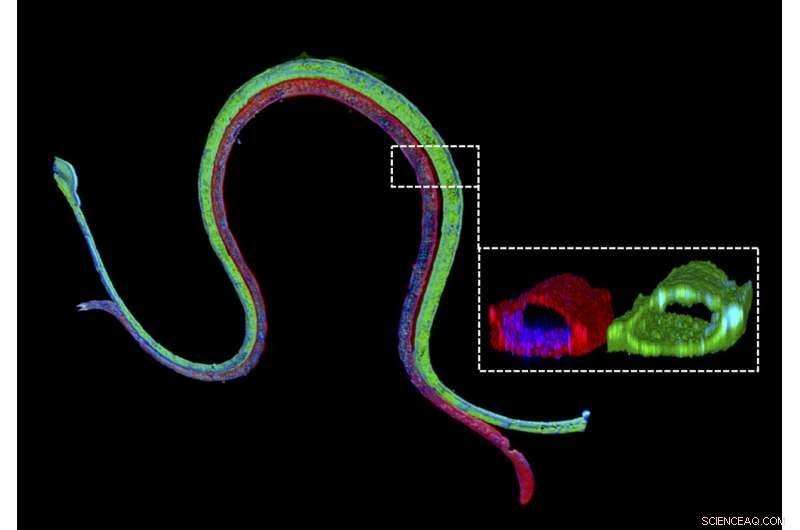
Immunofluorescentiekleuring van een 3D bioprinted gevasculariseerde proximale tubulus met een proximale tubulus epitheliale marker gekleurd in groen in het proximale tubulus kanaal en een vasculaire endotheliale marker gekleurd in rood in het aangrenzende vasculaire kanaal. De vergrote dwarsdoorsnede illustreert dat de twee verschillende celtypes luminale perfuseerbare structuren vormen in hun respectieve kanalen. Krediet:Wyss Institute aan de Harvard University
Elke dag pakken onze nieren de ontmoedigende taak aan om ons bloed continu te reinigen om verspilling te voorkomen, zout en overtollig vocht zich ophopen in ons lichaam. Om dit te behalen, de ongeveer een miljoen filtratie-eenheden van de nieren (glomeruli) verwijderen eerst zowel afvalproducten als kostbare voedingsstoffen uit de bloedstroom, vervolgens absorberen gespecialiseerde structuren, bekend als de proximale tubuli, de "goede" moleculen en brengen ze terug naar onze bloedbaan. Hoewel de reabsorptieve functies van de proximale tubulus kunnen worden aangetast door medicijnen, Chemicaliën, of genetische en door bloed overgedragen ziekten, ons begrip van hoe deze effecten optreden is nog beperkt.
Om de studie van renale reabsorptie buiten het menselijk lichaam mogelijk te maken, Wyss Institute Kernfaculteitslid Jennifer Lewis, Sc.D., en haar team dat werkt binnen het 3-D Organ Engineering Initiative van het Wyss Institute, dat zij mede leidt, en in samenwerking met het Roche Innovation Center Basel in Zwitserland, creëerde een 3D-gevasculariseerd proximaal tubulusmodel waarin onafhankelijk perfuseerbare tubuli en bloedvaten naast elkaar worden afgedrukt in een gemanipuleerde extracellulaire matrix. Dit werk bouwt voort op een continu geperfundeerd 3D proximaal tubulusmodel dat eerder door het team werd gerapporteerd en dat nog steeds geen functioneel bloedvatcompartiment had. Met behulp van hun apparaat van de volgende generatie, het team heeft het transport van glucose van de proximale tubulus naar de bloedvaten gemeten, samen met de effecten van hyperglykemie, een aandoening geassocieerd met diabetes bij patiënten. Hun studie is gepubliceerd in de Proceedings van de National Academy of Sciences ( PNAS ).
Lewis is ook de Hansjörg Wyss Professor of Biologically Inspired Engineering aan de Harvard John A. Paulson School of Engineering and Applied Science (SEAS), de Jianmin Yu Professor of Arts and Sciences en een lid van het Harvard Stem Cell Institute.
"We bouwen deze levende nierapparaten in een paar dagen en ze kunnen maandenlang stabiel en functioneel blijven, " zei eerste auteur Neil Lin, doctoraat, die een Roche Fellow en Postdoctoral Fellow is in het team van Lewis. "Belangrijk, deze 3-D gevasculariseerde proximale tubuli vertonen de gewenste epitheel- en endotheelcelmorfologieën en luminale architecturen, evenals de expressie en correcte lokalisatie van belangrijke structurele en transporteiwitten, en factoren waardoor de buisvormige en vasculaire compartimenten met elkaar kunnen communiceren."
Als eerste stap naar het testen van medicijnen en het modelleren van ziekten, het team veroorzaakte "hyperglykemie", een hoge glucose-aandoening die typisch is voor diabetes en een bekende risicofactor voor vaatziekten, in hun model door een viervoudig hogere dan normale glucoseconcentratie door het proximale tubuluscompartiment te laten circuleren. "We ontdekten dat hoge glucosespiegels die naar endotheelcellen in het vasculaire compartiment werden getransporteerd, celbeschadiging veroorzaakten, " zei Kimberly Homan, doctoraat, een co-auteur van de studie en Research Associate in Lewis' groep aan het Wyss Institute en SEAS. "Door een medicijn door de tubulus te laten circuleren dat specifiek een belangrijke glucosetransporteur in proximale tubulusepitheelcellen remt, we hebben voorkomen dat die schadelijke veranderingen plaatsvonden in de endotheelcellen in de aangrenzende bloedvaten."
De directe focus van het team is om deze modellen verder op te schalen voor gebruik in farmaceutische toepassingen. "Ons systeem zou het screenen van gerichte geneesmiddelenbibliotheken op niertoxiciteit mogelijk maken en zo dierproeven helpen verminderen, " zei Annie Moisan, doctoraat, een co-auteur en een industriële medewerker van het onderzoek, en Principal Scientist bij Roche Innovation Center Basel. "Ik ben enthousiast over de voortdurende inspanningen van ons en anderen om de fysiologische relevantie van dergelijke modellen te vergroten, bijvoorbeeld door het inbouwen van patiëntspecifieke en zieke cellen, aangezien gepersonaliseerde werkzaamheid en veiligheid de uiteindelijke doelen zijn van het voorspellen van klinische reacties op medicijnen."
"Ons nieuwe 3D-niermodel is een opwindende vooruitgang omdat het de proximale tubulussegmenten die in natief nierweefsel worden aangetroffen, vollediger recapituleert, " zei Lewis. "Naast de onmiddellijke toepassingen voor het screenen van geneesmiddelen en ziektemodellering, we onderzoeken ook of deze levende apparaten kunnen worden gebruikt om nierdialyse te verbeteren." Momenteel levensreddende dialysemachines filteren bloed, maar ze zijn niet in staat om kostbare voedingsstoffen en andere soorten uit het filtraat te halen dat het lichaam nodig heeft voor veel van zijn functies, die in de loop van de tijd specifieke tekortkomingen en complicaties kunnen veroorzaken. Lewis and her colleagues believe that 3-D bioprinted vascularized tubules may lead to improved renal replacement therapies.
"This study presents a significant step forward in human kidney engineering that enables human disease and drug-related studies to be carried out over extended periods of time in vitro. It also represents a major step forward for the Wyss Institute's 3-D Organ Engineering Initiative, which aims to generate functional organ replacements with enhanced functionalities for patients in need, " said Wyss Institute Founding Director Donald Ingber, MD, doctoraat, who is also the Judah Folkman Professor of Vascular Biology at HMS and the Vascular Biology Program at Boston Children's Hospital, as well as Professor of Bioengineering at SEAS.
 Squishy hydra's eenvoudige circuits klaar voor hun close-up
Squishy hydra's eenvoudige circuits klaar voor hun close-up Coronavirus-testkits worden ontwikkeld met behulp van nieuwe RNA-beeldvormingstechnologie
Coronavirus-testkits worden ontwikkeld met behulp van nieuwe RNA-beeldvormingstechnologie Zwavelzuur & chloor bleekreactie
Zwavelzuur & chloor bleekreactie Door kwallen geïnspireerde elektronische huid gloeit als hij pijn doet
Door kwallen geïnspireerde elektronische huid gloeit als hij pijn doet Een licht schijnen op wat er echt gebeurt in perovskiet-zonnecellen
Een licht schijnen op wat er echt gebeurt in perovskiet-zonnecellen
Hoofdlijnen
- Soorten forensische tests
- De controverse over de menselijke hersenen die nieuwe cellen maken
- Hoe worden bacteriën resistent tegen antibiotica?
- Hoe werkt het skelet met het ademhalingssysteem?
- Boot die Steinbeck naar de Zee van Cortez bracht wordt gerestaureerd
- Wat is sterker:nature of nurture?
- Mutualisme (biologie): definitie, types, feiten en voorbeelden
- Morfogenese en de ontwikkeling van levende vormen
- Nieuwe functie in genregulerend eiwit ontdekt
- Coronavirus:naarmate de cultuur online beweegt, regionale organisaties hebben hulp nodig bij het overbruggen van de digitale kloof

- Gebruik van DNA in seriemoordenaarsonde leidt tot bezorgdheid over privacy

- George Laurier, uitvinder van de alomtegenwoordige UPC, sterft op 94

- Rechtbank veroordeelt Ryanair om de Nederlandse wet na te leven

- NYSE bundelt krachten met Starbucks op bitcoin-platform

 Levenscyclus van een haai
Levenscyclus van een haai  Overeenkomsten tussen huidcellen en zenuwen
Overeenkomsten tussen huidcellen en zenuwen  Bereken de verliezen van transformatoren
Bereken de verliezen van transformatoren Noah-MP legt belangrijke hydrologische patronen vast in China
Noah-MP legt belangrijke hydrologische patronen vast in China Heeft racisme Jackie Robinson vermoord?
Heeft racisme Jackie Robinson vermoord? Nieuw ontwerp van de raketkuip zorgt voor een soepelere, stillere rit
Nieuw ontwerp van de raketkuip zorgt voor een soepelere, stillere rit Afvalwater bevat voedingsstoffen, energie en edele metalen - wetenschappers leren hoe ze deze kunnen terugwinnen
Afvalwater bevat voedingsstoffen, energie en edele metalen - wetenschappers leren hoe ze deze kunnen terugwinnen Zomerwolken kijken op Titan
Zomerwolken kijken op Titan
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Swedish | Dutch | Danish | Norway | Portuguese | German |

-
Wetenschap © https://nl.scienceaq.com

