
Wetenschap
Wat maakt het watermolecuul polair?
1. ongelijke delen van elektronen: Zuurstof is elektronegatiefer dan waterstof, wat betekent dat het elektronen sterker aantrekt. Dit zorgt ervoor dat de gedeelde elektronen in de O-H-obligaties meer tijd doorbrengen dichter bij het zuurstofatoom.
2. gebogen moleculaire geometrie: De twee waterstofatomen bevinden zich niet direct tegenover elkaar, maar vormen een gebogen vorm. Deze opstelling resulteert in een scheiding van lading in het molecuul.
3. Gedeeltelijke ladingen: Vanwege de ongelijke elektronenuitwisseling ontwikkelt het zuurstofatoom een gedeeltelijke negatieve lading (Δ-) en ontwikkelen de waterstofatomen gedeeltelijke positieve ladingen (Δ+). Dit creëert een dipoolmoment, waarbij het ene uiteinde van het molecuul enigszins negatief is en het andere uiteinde enigszins positief is.
Hier is een eenvoudige analogie:
Stel je het watermolecuul voor als een kleine magneet met een positieve pool en een negatieve pool. Het zuurstofatoom werkt als de negatieve pool en trekt de positieve uiteinden van andere polaire moleculen aan, terwijl de waterstofatomen werken als de positieve pool en de negatieve uiteinden aantrekken.
Deze polariteit maakt water tot een zeer effectief oplosmiddel, waardoor het vele andere polaire stoffen kan oplossen. Het draagt ook bij aan het hoge kookpunt van water, oppervlaktespanning en het vermogen om waterstofbruggen te vormen.
 Hoe heet de vloeistof uit een vrucht?
Hoe heet de vloeistof uit een vrucht?  Wat gebeurt er als een ijzeren nagel wordt ondergedompeld in kopersulfaatoplossing?
Wat gebeurt er als een ijzeren nagel wordt ondergedompeld in kopersulfaatoplossing?  Wat zijn de chemische vergelijkingen van processen die ijzer verfijnen?
Wat zijn de chemische vergelijkingen van processen die ijzer verfijnen?  Veranderingen in de bacteriële celwand produceren meer vetmoleculen
Veranderingen in de bacteriële celwand produceren meer vetmoleculen De wetenschap achter het bruisen:hoe bubbels drank maken
De wetenschap achter het bruisen:hoe bubbels drank maken
 Wat zijn allemaal objecten ergens op of nabij de aarde?
Wat zijn allemaal objecten ergens op of nabij de aarde?  Vrees voor de toekomst van de groene long van Mexico-Stad
Vrees voor de toekomst van de groene long van Mexico-Stad Aardbeienvelden voor altijd? De productie leidt tot langdurige plasticvervuiling, zo blijkt uit onderzoek
Aardbeienvelden voor altijd? De productie leidt tot langdurige plasticvervuiling, zo blijkt uit onderzoek  Hoe 'Dune' een baken werd voor de jonge milieubeweging en een strijdkreet voor de nieuwe wetenschap van de ecologie
Hoe 'Dune' een baken werd voor de jonge milieubeweging en een strijdkreet voor de nieuwe wetenschap van de ecologie  Waarom microbeads zo'n bedreiging vormen en waarom ze zo moeilijk te hanteren zijn
Waarom microbeads zo'n bedreiging vormen en waarom ze zo moeilijk te hanteren zijn
Hoofdlijnen
- Wat zijn de structuur en functie van eiwitten?
- Wanneer een bioloog wetenschappelijk tijdschrift leest om meer te weten te komen over hoe kankercellen vermenigvuldigen welke methode de vormverklaring gebruikt?
- Wat is de rol van zuurstof in cel?
- Mexico zegt dat de bedreigde vaquita-bruinvis in gevangenschap is gestorven
- Wat is een groep van dezelfde soort organismen die zich kunnen paren en de reproduceer van nakomelingen kunnen produceren?
- Cellen gebruiken actieve transporteiwitten om?
- Geef twee redenen waarom het vrijwel onmogelijk is om veel menselijke eigenschappen te associëren met enkele genen
- Wat zijn de vier lagen cellen gevonden op planten?
- Nieuw inzicht over hoe virussen gastheereiwitten in hun voordeel gebruiken
- Doorbraak in magnesiumbatterijen:nanogestructureerde kathode, begrip van nieuwe elektrolyt leidt tot grotere efficiëntie
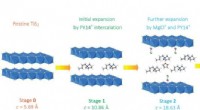
- Kleine implantaten voor cellen zijn functioneel in vivo
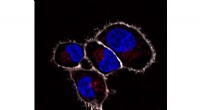
- De natuur biedt een sleutel tot het afstoten van vloeistoffen

- Nieuw biokatalytisch systeem zet afvalbiomassa om in chemicaliën met toegevoegde waarde
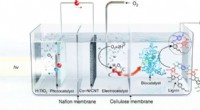
- Lab ontwikkelt grafeenelektrode met twee oppervlakken om water te splitsen in waterstof en zuurstof

 Stralingstechniek kan een minder schadelijk alternatief bieden voor röntgenstralen
Stralingstechniek kan een minder schadelijk alternatief bieden voor röntgenstralen Wat zijn drie manieren om in een rechte lijn te versnellen?
Wat zijn drie manieren om in een rechte lijn te versnellen?  Wat voor soort erosie komt voor in een llano -opheffing?
Wat voor soort erosie komt voor in een llano -opheffing?  Onderzoekers creëren volledig elektrische spintronica
Onderzoekers creëren volledig elektrische spintronica Hoe een nieuwe telescoop de uitdijing van het heelal zal meten
Hoe een nieuwe telescoop de uitdijing van het heelal zal meten  Wat zijn de oorzaken van veranderingen in kaart aarde?
Wat zijn de oorzaken van veranderingen in kaart aarde?  Wanneer is de potentiële energie van een basketbal het grootst?
Wanneer is de potentiële energie van een basketbal het grootst?  Wat zou er met de bal gebeuren als er geen wrijving of obstakels zouden zijn?
Wat zou er met de bal gebeuren als er geen wrijving of obstakels zouden zijn?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap & Ontdekkingen © https://nl.scienceaq.com

