Wetenschap
Hoe katalyseert het enzymreactie?
1. Substraatbinding:
* Enzymen hebben een specifieke driedimensionale vorm genaamd de actieve site. Deze site is complementair aan de vorm van het molecuul waar ze op werken, het substraat genoemd.
* Het enzym bindt aan het substraat door zwakke interacties (waterstofbruggen, elektrostatische interacties, van der Waals-krachten) die een enzym-substraatcomplex vormen. Deze binding brengt de substraatmoleculen in de juiste oriëntatie voor de reactie.
2. Activeringsenergie verlagen:
* De actieve enzymactieve site creëert een micro -omgeving die gunstig is voor de reactie om verder te gaan. Het kan dit op verschillende manieren doen:
* Stabilisatie van de overgangstoestand: Het enzym interageert met het substraat op een manier die de vorming van de overgangstoestand vergemakkelijkt, een energierijke, onstabiel tussenliggende tussenproduct dat moet worden gevormd om de reactie te verlopen.
* Alternatieve reactieroutes bieden: Enzymen kunnen soms alternatieve reactieroutes bieden die minder energie vereisen om de overgangstoestand te bereiken.
* Nabijheid en oriëntatie: Door de substraten te binden, brengt het enzym ze samen in de juiste oriëntatie voor de reactie. Dit verhoogt de kans op succesvolle botsingen tussen de moleculen.
3. Productvorming en release:
* Zodra de reactie is voltooid, geeft het enzym het product (en) vrij en keert terug naar de oorspronkelijke toestand, klaar om te binden aan een ander substraatmolecuul.
Belangrijke factoren die de enzymkatalyse beïnvloeden:
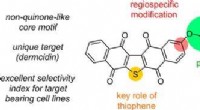
* specificiteit: Elk enzym katalyseert meestal slechts één of enkele reacties, vanwege de specifieke vorm van de actieve plaats.
* Temperatuur en pH: Enzymen hebben een optimale temperatuur en pH -bereiken waarbij ze het meest efficiënt werken. Buiten deze bereiken neemt hun activiteit af.
* Cofactors en co -enzymen: Sommige enzymen vereisen niet-eiwitmoleculen genaamd cofactors of co-enzymen om te functioneren. Deze moleculen kunnen helpen bij bindingssubstraten, het faciliteren van de reactie of het dragen van elektronen.
Voorbeelden van enzymkatalyse:
* lactase: Breekt lactose (melksuiker) af in glucose en galactose.
* DNA -polymerase: Repliceert DNA en kopieert de genetische code.
* pepsin: Breekt eiwitten in de maag af.
Concluderend zijn enzymen zeer efficiënte katalysatoren die biochemische reacties versnellen door een lagere energiepad te bieden voor de reactie. Dit wordt bereikt door specifieke substraatbinding, stabilisatie van de overgangstoestand en optimalisatie van reactieomstandigheden binnen de actieve plaats.
 Wat gebeurt er als u ijzersulfaat- en natriumhydroxide mengt?
Wat gebeurt er als u ijzersulfaat- en natriumhydroxide mengt?  Wat bedoel je met de pH van een oplossing?
Wat bedoel je met de pH van een oplossing?  Woordvergelijking voor oplosbaar metaaloxide plus water?
Woordvergelijking voor oplosbaar metaaloxide plus water?  Van overvloedige koolwaterstoffen tot zeldzame spinvloeistoffen
Van overvloedige koolwaterstoffen tot zeldzame spinvloeistoffen Wat gebeurt er met de buitenste schaal elektronen van een calcium wanneer het reageert met zuurstofatomen?
Wat gebeurt er met de buitenste schaal elektronen van een calcium wanneer het reageert met zuurstofatomen?
Hoofdlijnen
- Met welk systeem werkt het gespierde op de voet?
- Welk celweefsel kan stoffen absorberen en of scheiden?
- Hoe ratten onze koraalriffen doden
- Toenemend bewijs dat beren geen carnivoren zijn
- Informatie verkregen uit wetenschappelijk onderzoek wordt genoemd?
- Lasers en een aangepaste microscoop tonen het gensplitsingsproces in realtime
- Uit onderzoek blijkt dat harige dieven loslopen in een bos in Maine
- Wetenschappers geloven dat het leven is ontstaan in een wateromgeving Welk bewijs is er hiervoor?
- Waarom zeg je dat een enzym herbruikbaar is?
 Verandert een plant zijn uiterlijk door hoe bestoven?
Verandert een plant zijn uiterlijk door hoe bestoven?  Zeespiegel stijgt waarschijnlijk sneller dan eerder werd gedacht
Zeespiegel stijgt waarschijnlijk sneller dan eerder werd gedacht Wat is de geleidbaarheid voor natriumazide?
Wat is de geleidbaarheid voor natriumazide?  Hoe weten wetenschappers dat de eerste organismen eenvoudige eencellige organismen waren?
Hoe weten wetenschappers dat de eerste organismen eenvoudige eencellige organismen waren?  De ontziltingslozing van Sydney verhoogt het leven van vissen in tijden van klimaatonzekerheid
De ontziltingslozing van Sydney verhoogt het leven van vissen in tijden van klimaatonzekerheid Theorie voorspelt nieuw type binding die nanodeeltjeskristallen samenvoegt
Theorie voorspelt nieuw type binding die nanodeeltjeskristallen samenvoegt In welke bodemregio is Nahanni?
In welke bodemregio is Nahanni?  Is er een verlies van energie in interferentiefenomeen?
Is er een verlies van energie in interferentiefenomeen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap & Ontdekkingen © https://nl.scienceaq.com