
Wetenschap
Het ongelijke delen van elektronen in een molecuulwater is een voorbeeld van?
Dit is waarom:
* Covalente binding: Bij covalente binding delen atomen elektronen om een stabiele elektronenconfiguratie te bereiken.
* Polar: In een polaire covalente binding worden de elektronen niet gelijk gedeeld tussen de atomen. Dit gebeurt omdat het ene atoom een hogere elektronegativiteit heeft (een sterkere trek van elektronen) dan het andere.
* Watermolecuul: Zuurstof heeft een hogere elektronegativiteit dan waterstof. Dit betekent dat de gedeelde elektronen meer tijd dichter bij het zuurstofatoom doorbrengen, waardoor het een gedeeltelijke negatieve lading (Δ-) krijgt en de waterstofatomen met gedeeltelijke positieve ladingen (δ+) achterlaten.
Deze ongelijke delen van elektronen creëert een polaire molecuul met een positief uiteinde (de waterstofzijde) en een negatief uiteinde (de zuurstofzijde). Deze polariteit is verantwoordelijk voor veel van de unieke eigenschappen van water, zoals zijn vermogen om waterstofbindingen te vormen en als een goed oplosmiddel te fungeren.
 Californië moet nu handelen om zich voor te bereiden op zeespiegelstijging, staatswetgevers zeggen:
Californië moet nu handelen om zich voor te bereiden op zeespiegelstijging, staatswetgevers zeggen: Wat houdt planten strak aan de aarde?
Wat houdt planten strak aan de aarde?  Nieuwe genomische instrumenten voor drie moderne katoenvariëteiten zouden toekomstige veredelingsinspanningen kunnen sturen
Nieuwe genomische instrumenten voor drie moderne katoenvariëteiten zouden toekomstige veredelingsinspanningen kunnen sturen  Tropische storm Ewiniar aanlanding in China gezien door NASA's Aqua-satelliet
Tropische storm Ewiniar aanlanding in China gezien door NASA's Aqua-satelliet De relatie tussen levende wezens en hun omgeving?
De relatie tussen levende wezens en hun omgeving?
Hoofdlijnen
- Welke wormen reproduceren seksueel?
- Wat is een kenmerk van bacteriën die sleutel om ze onder controle te houden?
- Welk molecuul kruist een celmembraan vaker dan elke andere stof?
- Welk proces komt voor in een cellen mitochondria?
- Wat staat de vrije uitwisseling van ideeën tussen wetenschappelijke velden toe?
- Hoe maakt DNA een kopie van zichzelf om buiten eiwitten te reizen?
- Mutaties die veroudering beïnvloeden:vaker voorkomend dan we dachten?
- Waarom krijgen demonen de schuld van slaapverlamming?
- Elektrische velden in kaart brengen om te helpen ontrafelen hoe enzymen werken
- Hoe langzamer ze draaien, hoe helderder ze gloeien

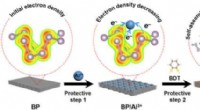
- De reactiviteit van zwarte fosfor reguleren door middel van beschermende chemie
- Ingenieurs maken slimme aerogel die lucht in drinkwater verandert

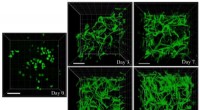
- Biopolymeren voor wondtherapie leveren stamcellen om de genezing te verbeteren
- Diagnostisch hulpmiddel voor coronavirus maakt belangrijke stap voorwaarts

 Kan een criticus die een gelovige is geworden, anderen beïnvloeden? Het geval van genetisch gemodificeerd voedsel
Kan een criticus die een gelovige is geworden, anderen beïnvloeden? Het geval van genetisch gemodificeerd voedsel  Chemici maken nanodeeltjes voor veilige beeldvorming van tumoren
Chemici maken nanodeeltjes voor veilige beeldvorming van tumoren Wat is het massa -nummer en atoom van stikstof?
Wat is het massa -nummer en atoom van stikstof?  Wat is de snelheid van gerichte beweging een lichaam op een oogwenk?
Wat is de snelheid van gerichte beweging een lichaam op een oogwenk?  Problemen aan de horizon voor genetisch gemodificeerde gewassen?
Problemen aan de horizon voor genetisch gemodificeerde gewassen?  Welke structuur isoleert neuronen?
Welke structuur isoleert neuronen?  Is suikerwater ionisch of covalent?
Is suikerwater ionisch of covalent?  'S Werelds eerste systeem voorspelt opwarming van meren wereldwijd
'S Werelds eerste systeem voorspelt opwarming van meren wereldwijd
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap & Ontdekkingen © https://nl.scienceaq.com

