
Wetenschap
Waarom is het volume van een gas meer dan die vloeistof?
* deeltjesafstand: In een gas liggen de deeltjes veel verder uit elkaar dan in een vloeistof. Ze bewegen vrij en willekeurig, botsen tegen elkaar en de wanden van hun container. Deze grote scheiding tussen deeltjes is waarom gassen gemakkelijk samendrukbaar zijn.
* Krachten van aantrekkingskracht: De aantrekkelijke krachten tussen gasdeeltjes zijn erg zwak. Hierdoor kunnen ze zich vrij bewegen en verspreiden om het hele volume van hun container te vullen. Vloeistoffen daarentegen hebben sterkere intermoleculaire krachten, die de deeltjes dichter bij elkaar houden.
* Kinetische energie: Gasdeeltjes hebben een hogere kinetische energie dan vloeibare deeltjes. Dit betekent dat ze sneller en met meer kracht bewegen, wat verder bijdraagt aan hun grotere volume.
Denk er op deze manier aan:
* gas: Stel je een kamer vol mensen voor die allemaal vrij bewegen en tegen elkaar en de muren tegenkomen. Dit is vergelijkbaar met hoe gasdeeltjes zich gedragen.
* vloeistof: Stel je dezelfde kamer voor, maar nu is iedereen strak vol, nog steeds beweegt maar met minder vrijheid. Dit is als de deeltjes in een vloeistof.
Belangrijke opmerking: Er zijn enkele uitzonderingen op deze algemene regel. Bij extreme druk kan het volume van een gas bijvoorbeeld worden verminderd om vergelijkbaar te zijn met dat van een vloeistof.
 Verwacht minder, maar meer destructieve aan land vallende tropische cyclonen
Verwacht minder, maar meer destructieve aan land vallende tropische cyclonen Welke rol spelen bossen voor natuurlijk overstromingsbeheer in het VK?
Welke rol spelen bossen voor natuurlijk overstromingsbeheer in het VK? Waarom is het niet altijd nuttig om de natuurlijke wereld met modellen te vertegenwoordigen?
Waarom is het niet altijd nuttig om de natuurlijke wereld met modellen te vertegenwoordigen?  Nog een vitaal bos in gevaar:wetenschappers vrezen dat opwarmend water de kelpbedden van Puget Sounds kan doden
Nog een vitaal bos in gevaar:wetenschappers vrezen dat opwarmend water de kelpbedden van Puget Sounds kan doden Wat is de wetenschap van het vinden van patronen tussen levende wezens?
Wat is de wetenschap van het vinden van patronen tussen levende wezens?
Hoofdlijnen
- Wat zijn twee soorten geleiding in een neuron?
- Neanderthalers waren eigenlijk prehistorische Picasso's
- Een speciale klasse consumenten die zijn energie ontleent aan dode organismen en organische afval?
- Wat zijn fossiele brandstoffen biotisch of abiotisch?
- Wat definieer logica als een wetenschap?
- Wat zijn de zuignappen op een Octopus genaamd?
- Wat eet Ambeoa?
- Wat is een reeks structuren die in de kern zijn gevonden, DNA plus wat eiwit?
- Onderzoek toont aan hoe een gen planten helpt hun eiwitproductie in stressvolle tijden te beheersen
- Wetenschappers vinden verband tussen belangrijk plantenaminozuur en essentiële hormonen

- Onderzoek levert nieuw ontwerpprincipe op voor watersplitsende katalysatoren

- Nieuwe tool is bedoeld om COVID-19 te bestrijden, andere ziekten
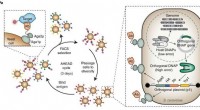
- Onderzoekers ontwikkelen gelaagd kobaltoxide met een record-setting thermo-elektrisch cijfer van verdienste

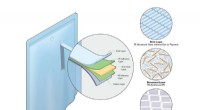
- Een beter polyethyleen bouwen
 NASA's Europa Clipper maakt een crosscountryvlucht naar Florida
NASA's Europa Clipper maakt een crosscountryvlucht naar Florida  Hoe wordt een aardpijler gevormd?
Hoe wordt een aardpijler gevormd?  Het zijn niet allemaal regenbogen voor Chicago's $ 1 miljard technische eenhoorns
Het zijn niet allemaal regenbogen voor Chicago's $ 1 miljard technische eenhoorns De verandering van Engeland Biston betularia mottenpopulaties van licht gekleurd tot donker is een voorbeeld van?
De verandering van Engeland Biston betularia mottenpopulaties van licht gekleurd tot donker is een voorbeeld van?  In welke stoffen kan convectie gebeuren?
In welke stoffen kan convectie gebeuren?  Is helium overvloediger meer dan Argon?
Is helium overvloediger meer dan Argon?  Welk molecuul wordt gebruikt tijdens aerobe ademhaling?
Welk molecuul wordt gebruikt tijdens aerobe ademhaling?  Complex levend weefsel bioprinten in slechts enkele seconden
Complex levend weefsel bioprinten in slechts enkele seconden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

