
Wetenschap
Welk deel van de metaalbindingstheorie helpt het meest om uit te leggen waarom metalen elektriciteit kunnen leiden?
* Gedelokaliseerde elektronen: Bij metalen binding zijn de valentie -elektronen niet stevig gebonden aan individuele atomen. In plaats daarvan vormen ze een "zee" van gedelokaliseerde elektronen die vrij door het hele metalen rooster kunnen bewegen.
* elektrische geleidbaarheid: Wanneer een elektrisch potentieel over een metaal wordt toegepast, worden deze vrije elektronen gemakkelijk versneld door het elektrische veld. Deze beweging van elektronen vormt een elektrische stroom, waardoor metalen uitstekende elektriciteitsgeleiders worden.
In tegenstelling tot andere bindtypen:
* ionische binding: Elektronen worden stevig vastgehouden door ionen, waardoor het voor hen moeilijk is om te bewegen en elektriciteit te leiden.
* Covalente binding: Elektronen worden gedeeld tussen specifieke atomen en ze zijn niet vrij om gemakkelijk te bewegen.
Kortom, het gedelokaliseerde elektronenmodel verklaart de hoge elektrische geleidbaarheid van metalen omdat het een mechanisme biedt voor ladingsdragers (elektronen) om vrij door het materiaal te bewegen.
 Hittegolven en bosbranden om luchtvervuiling te verergeren:UN
Hittegolven en bosbranden om luchtvervuiling te verergeren:UN Eilanden in de lucht:kunnen steile heuveltoppen een veilige haven bieden voor bedreigde diersoorten?
Eilanden in de lucht:kunnen steile heuveltoppen een veilige haven bieden voor bedreigde diersoorten?  Is het waar dat water de neiging heeft om te diffunderen van een gebied waar de droesem geconcentreerd is naar zeer geconcentreerd?
Is het waar dat water de neiging heeft om te diffunderen van een gebied waar de droesem geconcentreerd is naar zeer geconcentreerd?  Studie onderzoekt wat sterke natuurkundeleraren maakt
Studie onderzoekt wat sterke natuurkundeleraren maakt  Voedselkeuzes van consumenten kunnen de uitstoot van broeikasgassen helpen verminderen en bijdragen aan klimaatverandering
Voedselkeuzes van consumenten kunnen de uitstoot van broeikasgassen helpen verminderen en bijdragen aan klimaatverandering
Hoofdlijnen
- Hoe bacteriën hypothiocyaniet onschadelijk maken, een antimicrobieel wapen van het aangeboren immuunsysteem
- Parasitaire ooginfectie vormt een aanzienlijke bedreiging voor Britse honden, waarschuw experts
- Ponso helpen, enige overlevende van Chimpansee-eiland in I. Coast
- Is het waar of onwaar dat chromosomen die genen dragen worden gevonden in de kern van cel?
- Hoe zijn gymnospermen en angiospermen verschillend?
- Hoe de microprocessor de miRNA-productie nauwkeurig initieert
- Wat zou er met een voedselketen gebeuren als de populatie van één organisme zou toenemen?
- Welk orgaan heeft een vetvoedsel effect?
- Het gebied van een lang bot waar lengtegroei optreedt, is het?
- Nieuwe slimme sensor kan een revolutie teweegbrengen in de preventie van misdaad en terrorisme

- Elektroreductie van koolmonoxide voor de zeer selectieve productie van ethyleen
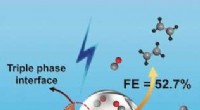
- Onderzoekers onthullen robuuste ethaan-vangende poreuze organische kooi voor efficiënte ethyleenzuiveringstoepassing

- Russische wetenschappers ontwikkelen een slim sorptiemiddel voor waterzuivering

- Nieuwe antivirale, antibacterieel oppervlak kan de verspreiding van infecties in ziekenhuizen verminderen

 Insectenkrakende reptielen op oude eilanden van het VK
Insectenkrakende reptielen op oude eilanden van het VK Mineralen met de silicium-zuurstofstructuur worden ingedeeld in welke groep?
Mineralen met de silicium-zuurstofstructuur worden ingedeeld in welke groep?  Het ene soort atoom verandert in het andere en daarbij komt energie vrij?
Het ene soort atoom verandert in het andere en daarbij komt energie vrij?  Techno-fix futures zullen de klimaatchaos alleen maar versnellen - geloof de hype niet!
Techno-fix futures zullen de klimaatchaos alleen maar versnellen - geloof de hype niet! Gletsjermuizen:deze kuddes mosballen zwerven over het ijs - en ontrafelen hun mysteries
Gletsjermuizen:deze kuddes mosballen zwerven over het ijs - en ontrafelen hun mysteries Een positief geladen deeltje van een element zoals NA en CA?
Een positief geladen deeltje van een element zoals NA en CA?  Hoeveel oz is gelijk aan 9 gram?
Hoeveel oz is gelijk aan 9 gram?  Bepaalt amplitude de energie van een golf?
Bepaalt amplitude de energie van een golf?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

