
Wetenschap
Wat is de basis van binding in zee -elektronen?
1. Gedelokaliseerde elektronen:
* In metalen elementen zijn de buitenste elektronen zeer losjes gebonden aan de atomen.
* Deze elektronen zijn niet geassocieerd met een bepaald atoom en zijn vrij om door het hele metalen rooster te bewegen.
* Deze "zee" van gedelokaliseerde elektronen werkt als een "lijm" die de positief geladen metaalionen bij elkaar houdt.
2. Elektrostatische aantrekkingskracht:
* De positief geladen metaalionen worden aangetrokken door de negatief geladen elektronenzee.
* Deze sterke elektrostatische aantrekkingskracht is de primaire kracht die verantwoordelijk is voor de binding in metalen.
3. Eigenschappen van metalen binding:
* Hoge elektrische geleidbaarheid: De gedelokaliseerde elektronen kunnen gemakkelijk door het metaal stromen, waardoor het een uitstekende geleider van elektriciteit is.
* Hoge thermische geleidbaarheid: De vrije elektronen kunnen snel warmte -energie door het metaal overbrengen.
* kneedbaarheid en ductiliteit: Metalen kunnen in vellen worden gehamerd (kneedbaar) of in draden (ductiel) worden getrokken omdat de lagen atomen langs elkaar kunnen glijden zonder de metalen bindingen te verbreken.
* Luster: Metalen hebben een glanzend uiterlijk vanwege de interactie van licht met de gedelokaliseerde elektronen.
4. Voorbeelden:
* Alle metalen, zoals goud, koper, ijzer, aluminium en natrium, vertonen metalen binding.
Sleutelpunten:
* Metallic binding is een uniek type binding dat specifiek in metalen optreedt.
* De "zee" van gedelokaliseerde elektronen is cruciaal voor de eigenschappen van metalen.
* De sterke elektrostatische aantrekkingskracht tussen de elektronenzee en de metaalionen is de basis van deze binding.
 Een voorbeeld geven van een ruwe vaste stof?
Een voorbeeld geven van een ruwe vaste stof?  Hoeveel liter water kan er bij STP gemaakt worden uit 34 gram zuurstofgas en 6,0 waterstof?
Hoeveel liter water kan er bij STP gemaakt worden uit 34 gram zuurstofgas en 6,0 waterstof?  Welk gedeelte op het periodieke tabel is goud?
Welk gedeelte op het periodieke tabel is goud?  Wetenschappers stellen een nieuwe technologie voor voor het maken van microstructuren van magneten
Wetenschappers stellen een nieuwe technologie voor voor het maken van microstructuren van magneten Wat is het product als natriumcarbonaat reageert met calciumchloride?
Wat is het product als natriumcarbonaat reageert met calciumchloride?
 Noordelijk halfrond wordt geconfronteerd met een 4-voudige stijging in perioden van extreme hitte:studie
Noordelijk halfrond wordt geconfronteerd met een 4-voudige stijging in perioden van extreme hitte:studie Noordelijke bosbranden kunnen klimaatverandering versnellen
Noordelijke bosbranden kunnen klimaatverandering versnellen Dire toekomst geëtst in het verleden:CO2 op 3 miljoen jaar oude niveaus
Dire toekomst geëtst in het verleden:CO2 op 3 miljoen jaar oude niveaus Welke twee dingen biedt de zon om op aarde te leven?
Welke twee dingen biedt de zon om op aarde te leven?  Studie heeft tot doel microbiële informatie te gebruiken om wereldwijde modellen voor klimaatverandering te informeren
Studie heeft tot doel microbiële informatie te gebruiken om wereldwijde modellen voor klimaatverandering te informeren
Hoofdlijnen
- Heeft het Golgi -apparaat een membraan?
- Hoeveel genen zijn er nodig om te leren? Lessen van zeeslakken
- Welke wetenschapper gebruikte gekookte runderbouillon en kolven met S-vormige slang om aan te tonen dat de theorie van spontane generatie onjuist is?
- Laboratorium- en natuurlijke stammen van darmbacteriën blijken vergelijkbare mutatieprofielen te hebben
- Wat is bacteriële suspensie?
- Wat werkt het STEM -orgel?
- De hongerige insecten die de mestcrisis in Oeganda bestrijden
- Indringende vraag:Waarom overleefden zoogdieren het 'K/T-uitsterven'?
- Hoe staat de lob naast je oren?
- Extreme biomimetica - de zoektocht naar natuurlijke bronnen van materiaaltechnische inspiratie
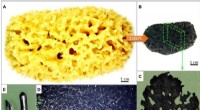
- Wetenschappers ontwikkelen elektrochemisch platform voor celvrije synthetische biologie

- Onderzoekers bestuderen historische ontwikkelingen van het periodiek systeem van chemische elementen

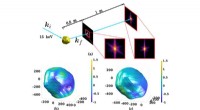
- Nieuwe rekentechniek lost gecomprimeerde röntgengegevens op
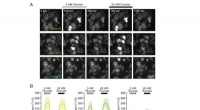
- Op groene fluorescerende eiwitten gebaseerde glucose-indicatoren voor realtime monitoring van het glucosemetabolisme
 Hoe milieu en micro-organismen de biogeochemische processen in de bodem in Tibetaanse wetlands reguleren
Hoe milieu en micro-organismen de biogeochemische processen in de bodem in Tibetaanse wetlands reguleren  Waarom stijgt de maan in de ochtend niet 's nachts?
Waarom stijgt de maan in de ochtend niet 's nachts?  In welk verband zit Saturnus?
In welk verband zit Saturnus?  Er kunnen vreemde gluonverbindingen op de loer liggen in de protonen
Er kunnen vreemde gluonverbindingen op de loer liggen in de protonen Wat zijn de groepen elektromagnetische golven om de energie te vergroten?
Wat zijn de groepen elektromagnetische golven om de energie te vergroten?  Welk sterrenbeeld wordt meestal niet geassocieerd met mythe?
Welk sterrenbeeld wordt meestal niet geassocieerd met mythe?  Wat wordt de naam gegeven aan het huidige geologische tijdperk?
Wat wordt de naam gegeven aan het huidige geologische tijdperk?  Noemen paleontologen te veel soorten?
Noemen paleontologen te veel soorten?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

