
Wetenschap
Wat gebeurt er als een stof van state of vloeistof van toestand verandert?
vast tot vloeistof (smelten):
* Energie wordt geabsorbeerd: Warmte -energie wordt geabsorbeerd door de vaste stof, waardoor de moleculen sneller trillen.
* De afstand tussen moleculen neemt toe: Naarmate de trillingen toenemen, beginnen de moleculen los te breken van hun vaste posities in de vaste structuur.
* structuur verzwakt: De georganiseerde, rigide structuur van de vaste stof breekt af.
* vloeistofeigenschappen ontstaan: De moleculen zijn nu vrij om langs elkaar te bewegen, waardoor de substantie het vermogen om te stromen (een eigenschap van vloeistoffen) hebben.
vloeistof tot gas (koken of verdamping):
* Energie wordt geabsorbeerd: Warmte -energie wordt geabsorbeerd door de vloeistof, waardoor de moleculaire trillingen verder worden verhoogd.
* De afstand tussen moleculen neemt dramatisch toe: De moleculen krijgen voldoende energie om de aantrekkelijke krachten te overwinnen die ze bij elkaar houden in de vloeibare toestand en ontsnappen in de gasfase.
* Vloeistofeigenschappen worden meer uitgesproken: De moleculen zijn nu erg ver uit elkaar en bewegen zich vrij, waardoor het gas wordt uitgebreid om de container te vullen.
Belangrijke opmerking: De tegenovergestelde processen (bevriezen en condensatie) omvatten de afgifte van warmte -energie als de stof van toestand verandert.
Hier is een eenvoudige analogie:
* Stel je de moleculen voor in een vaste, zoals mensen in een drukke metroauto. Ze zijn strak verpakt en kunnen maar een beetje bewegen.
* Wanneer de solide smelt, is het net als de opening van de metrot en mensen kunnen zich vrij bewegen, maar toch in de auto blijven. Dit is de vloeibare toestand.
* Wanneer de vloeistof kookt, is het alsof iedereen uit de metro -auto springt en zich over het platform verspreidt. Dit is de gasstatus.
 Reageren koolstof met chloor om een ionische verbinding te vormen?
Reageren koolstof met chloor om een ionische verbinding te vormen?  Nieuwe techniek kan medicijnontwerp stroomlijnen
Nieuwe techniek kan medicijnontwerp stroomlijnen Kleine sensoren ontwikkeld om de geheimen van hersenchemie te bestuderen
Kleine sensoren ontwikkeld om de geheimen van hersenchemie te bestuderen Hoeveel ijzer is nodig om te reageren met 48,0 gram zwavel in de reactie 2Fe plus 3s levert Fe2S3 op?
Hoeveel ijzer is nodig om te reageren met 48,0 gram zwavel in de reactie 2Fe plus 3s levert Fe2S3 op?  Bindingen verbreken om bindingen te vormen:nieuwe chemische reactie met potentiële toepassingen in de medicinale chemie
Bindingen verbreken om bindingen te vormen:nieuwe chemische reactie met potentiële toepassingen in de medicinale chemie
Hoofdlijnen
- Wat is een dorsale wortel en wat voor soort neuron in deze structuur?
- Hoe verschilt de vorm van epitheelcellen van wangcellen?
- In welk proces worden fossielen gevormd door de compressie van dode organismen in de loop van de tijd?
- Onderzoek verklaart waarom bepaalde immuuntherapieën niet altijd werken zoals voorspeld
- Waarom is een lichaam minder snel afgewezen en allograft als het uit het relatieve komt?
- Een ondergrondse stengel die vaatweefsel bezit is een.?
- Waarom verlaten zoveel vrouwen de biologie?
- Welk scholing is nodig om een menselijke bioloog te worden?
- Verdienen jeugdmoordenaars levenslang zonder voorwaardelijke vrijlating?
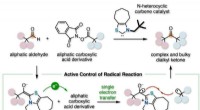
- Organokatalysator die radicale reacties regelt voor complexe en omvangrijke synthese van verbindingen
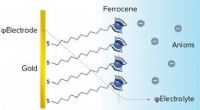
- Gecombineerde aanpak om grensvlakelektrochemie in meer detail te onderzoeken
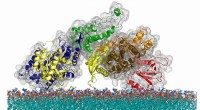
- Alzheimerziekte zorgt ervoor dat cellen oververhit raken en bakken als eieren
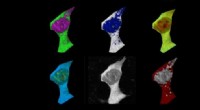
- Baanbrekende studie van celsignalering belooft veel voor immuunonderzoek en daarbuiten
- Elektrokatalysatoren voor waterstofproductie onttronen met goedkoop alternatief materiaal

 Welk ion is het enige negatieve dat aanwezig is in een waterige oplossing van Arrhenius-base?
Welk ion is het enige negatieve dat aanwezig is in een waterige oplossing van Arrhenius-base?  Wat zijn 8 voorbeelden van mineralen?
Wat zijn 8 voorbeelden van mineralen?  Ik ben een Trojaanse jongen van grote schoonheid die Zeus meeslepte om de goden te zijn. Welke maan ik?
Ik ben een Trojaanse jongen van grote schoonheid die Zeus meeslepte om de goden te zijn. Welke maan ik?  Een nieuwe magnetische nano-immuunkraal kan een snellere manier bieden om SARS-CoV-2 te vangen
Een nieuwe magnetische nano-immuunkraal kan een snellere manier bieden om SARS-CoV-2 te vangen  Hoe voelt tafelzout aan?
Hoe voelt tafelzout aan?  Apple hanteert een zeer on-tech benadering bij het oplossen van nepnieuws:menselijke redacteuren
Apple hanteert een zeer on-tech benadering bij het oplossen van nepnieuws:menselijke redacteuren Olie en water kunnen onder extreme druk vermengen
Olie en water kunnen onder extreme druk vermengen Is het tijd voor een nieuw tribunaal voor financiële diensten?
Is het tijd voor een nieuw tribunaal voor financiële diensten?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

