
Wetenschap
Hoe verandert de snelheid van moleculengas wanneer verwarmd?
* Kinetische energie: Warmte is een vorm van energie en wanneer u warmte aan een gas toevoegt, verhoogt u de kinetische energie van zijn moleculen. Kinetische energie is de energie van beweging.
* snellere beweging: Terwijl de moleculen kinetische energie krijgen, bewegen ze sneller. Deze verhoogde beweging manifesteert zich als hogere gemiddelde snelheid.
* Verhoogde botsingen: De sneller bewegende moleculen botsen vaker en met een grotere kracht tegen elkaar en de wanden van hun container. Deze verhoogde botsingssnelheid is wat we als hogere druk beschouwen.
Sleutelpunten:
* Gemiddelde snelheid: We praten over de * gemiddelde * snelheid van gasmoleculen omdat ze constant in willekeurige richtingen bewegen.
* Temperatuur en snelheid: De temperatuur van een gas is recht evenredig met de gemiddelde kinetische energie van zijn moleculen. Dit betekent dat hogere temperaturen overeenkomen met hogere gemiddelde snelheden.
* Verdeling van snelheden: Hoewel de gemiddelde snelheid toeneemt, bewegen de moleculen niet allemaal met dezelfde snelheid. Er is een verdeling van snelheden, waarbij sommige moleculen heel langzaam en andere heel snel bewegen.
Samenvattend verhoogt het verwarmen van een gas de snelheid van zijn moleculen als gevolg van de toename van kinetische energie, wat resulteert in een hogere druk en een bredere verdeling van moleculaire snelheden.
 Onderzoekers melden doorbraak in ijsafstotende materialen
Onderzoekers melden doorbraak in ijsafstotende materialen Wat is de oxidatietoestand van waterstof in peroxide?
Wat is de oxidatietoestand van waterstof in peroxide?  Waar zou een deeltje met lading van plus E worden gevonden in atoom?
Waar zou een deeltje met lading van plus E worden gevonden in atoom?  Subatomair deeltje dat het element definieert?
Subatomair deeltje dat het element definieert?  Volledig hydrofobe ionogel ontwikkeld voor draagbare onderwatersensor en communicator
Volledig hydrofobe ionogel ontwikkeld voor draagbare onderwatersensor en communicator
 Hoe het oogsten van natuurlijke producten mensen op het platteland kan helpen de armoede te verslaan
Hoe het oogsten van natuurlijke producten mensen op het platteland kan helpen de armoede te verslaan Westelijkste provincie van Canada roept noodtoestand uit vanwege bosbranden
Westelijkste provincie van Canada roept noodtoestand uit vanwege bosbranden NASA krijgt een infraroodbeeld van orkaan Oscar
NASA krijgt een infraroodbeeld van orkaan Oscar Waar uw recycling daadwerkelijk naartoe gaat – en wat u eraan kunt doen op deze Dag van de Aarde
Waar uw recycling daadwerkelijk naartoe gaat – en wat u eraan kunt doen op deze Dag van de Aarde  Wetenschappers krijgen vroeg inzicht in orkaanschade aan Caribische koraalriffen
Wetenschappers krijgen vroeg inzicht in orkaanschade aan Caribische koraalriffen
Hoofdlijnen
- Kan een criticus die een gelovige is geworden, anderen beïnvloeden? Het geval van genetisch gemodificeerd voedsel
- Hoe cellen DNA-schadeherstelroutes selecteren
- Wat is de naam van een gespecialiseerde cellen van een groep die unieke materialen om hen heen produceren?
- Zouden slaaphaaien op beschermde Steller-zeeleeuwen kunnen jagen?
- De sleutel tot het kweken van natuurlijk weefsel voor de reconstructie van het vrouwelijk voortplantingssysteem ontgrendeld
- Waarom is cytoplasma vergeleken met Jelly?
- Sprinkhanenonderzoek zou ons kunnen vertellen waarom Elvis de voorkeur gaf aan boterhammen met pindakaas
- Hoe evolutie werkt
- Aminozuren: functie, structuur, typen
- Vaak over het hoofd gezien, reguleren moleculen die glycanen worden genoemd de functie van COVID-19 spike-eiwitten
- Onderzoekers ruimen de ammoniakproductie drastisch op en verlagen de kosten

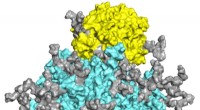
- Nieuw functioneel inzicht in eiwitcomplex, mogelijk nieuw doelwit voor antibiotica
- Upcycling van sponsachtig plastic schuim van schoenen, matrassen en isolatie

- Handdesinfecterend middel opnieuw ontwerpen en doneren 7, 000 gallons om COVID-19 te bestrijden

 Optische technieken bieden snelle, efficiënte COVID-19-detectie
Optische technieken bieden snelle, efficiënte COVID-19-detectie Onderzoek:gekleurde gemeenschappen lopen het grootste risico op blootstelling aan pesticiden in Ventura County, Californië
Onderzoek:gekleurde gemeenschappen lopen het grootste risico op blootstelling aan pesticiden in Ventura County, Californië Algemene benadering voor de oplossing van roostermaattheorieën
Algemene benadering voor de oplossing van roostermaattheorieën Quantinuum-kwantumcomputer die de logische kwantumbits van Microsoft gebruikt, voert 14.000 experimenten uit zonder fouten
Quantinuum-kwantumcomputer die de logische kwantumbits van Microsoft gebruikt, voert 14.000 experimenten uit zonder fouten  Waarom doen mensen de Amerikaanse wetenschap?
Waarom doen mensen de Amerikaanse wetenschap?  Nieuwe metingen suggereren antineutrino anomalie gevoed door modelleringsfout
Nieuwe metingen suggereren antineutrino anomalie gevoed door modelleringsfout Wat zijn 2 ontdekkingen die Edwin Hubble heeft gedaan die astronomie hebben veranderd?
Wat zijn 2 ontdekkingen die Edwin Hubble heeft gedaan die astronomie hebben veranderd?  Wat is de evenwichtige vergelijking voor zwaveldioxide en waterdamp?
Wat is de evenwichtige vergelijking voor zwaveldioxide en waterdamp?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

