
Wetenschap
Vloeistoffen hebben meestal hogere volumecoëfficiënten van expansie dan vaste stoffen?
Dit is waarom:
* intermoleculaire krachten: Vloeistoffen hebben zwakkere intermoleculaire krachten dan vaste stoffen. Dit betekent dat de moleculen in een vloeistof minder strak gebonden zijn en meer vrijheid hebben om te bewegen.
* afstand: De moleculen in een vloeistof zijn verder uit elkaar dan die in een vaste stof. Deze verhoogde afstand zorgt voor meer uitbreiding wanneer de temperatuur toeneemt.
in eenvoudiger termen: Stel je een doos voor gevuld met knikkers (die moleculen vertegenwoordigen). In een vaste stof zijn de knikkers strak verpakt. In een vloeistof hebben ze meer ruimte om te bewegen. Wanneer u de doos verwarmt, zullen de knikkers in de vloeistof zich meer verspreiden dan de knikkers in de vaste stof, wat leidt tot een grotere volumeverandering (uitbreiding).
Voorbeeld: Water breidt uit wanneer het bevriest omdat de moleculen zich regelen in een minder compacte structuur in ijs. Dit is een extreem voorbeeld, maar het illustreert het concept van hoe vloeistoffen een grotere volume -uitbreiding kunnen hebben in vergelijking met vaste stoffen.
 Zeespiegelstijging door ijskappen volgt scenario voor klimaatverandering in het slechtste geval
Zeespiegelstijging door ijskappen volgt scenario voor klimaatverandering in het slechtste geval Hoe noem je de studie van de ultieme aard- en significantiewaarden?
Hoe noem je de studie van de ultieme aard- en significantiewaarden?  De veranderende chemie van de Amazone-atmosfeer
De veranderende chemie van de Amazone-atmosfeer Wereld zou 700 miljoen ton CO2 kunnen besparen als mensen meer zouden fietsen, blijkt uit onderzoek
Wereld zou 700 miljoen ton CO2 kunnen besparen als mensen meer zouden fietsen, blijkt uit onderzoek Orkaan Sandy heeft mogelijk de gentrificatie in Brooklyn en Queens verergerd
Orkaan Sandy heeft mogelijk de gentrificatie in Brooklyn en Queens verergerd
Hoofdlijnen
- Als onderzoekers niet over de eiwitten beschikken die ze nodig hebben, kunnen ze AI ertoe brengen nieuwe structuren te hallucineren
- Waarom wordt het DNA in kern bewaard?
- Verwijzend naar alle levensprocessen van het lichaam?
- Wat fossielen onthullen over hybridisatie van vroege mensen
- Bacterieel model helpt onthullen hoe ons lichaam bevolkingsexplosies – en kanker – voorkomt
- Wat is het verschil tussen antebrachium en brachium?
- De vliegsnelheid van vogels is complexer dan eerder werd gedacht
- Wat fossielen onthullen over de hybridisatie van vroege mensen
- Wat is een gameet Wat kun je in termen van het aantal allelen voor elk gen doen over hoe gameten verschillen van andere cellen in volwassen erwtenplanten?
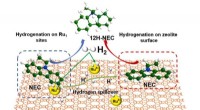
- Synergistische katalysatoren voor zeer efficiënte waterstofopslag
- Zeer elastische biologisch afbreekbare hydrogel voor bioprinten van nieuwe weefsels

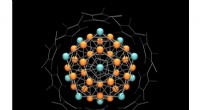
- Heterometallische koper-aluminium superatoom ontdekt
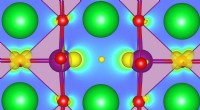
- Onderzoekers verbeteren de beschrijving van defecte oxiden met de eerste principes-berekening
- Teams-foto van crack in the act kan technische storingen voorkomen

 Zelfkoelende frisdrankflessen?
Zelfkoelende frisdrankflessen?  Creatie zonder contact in de botsingen van lood- en goudkernen
Creatie zonder contact in de botsingen van lood- en goudkernen Stranden open na lekkage van rioolwater aan de centrale kust van Californië
Stranden open na lekkage van rioolwater aan de centrale kust van Californië Mensen gebruiken kunstmatige intelligentie om hun scheiding te regelen. Zou jij?
Mensen gebruiken kunstmatige intelligentie om hun scheiding te regelen. Zou jij? Wetenschappers visualiseren de structuur van de belangrijkste DNA-reparatiecomponent met een bijna-atomaire resolutie
Wetenschappers visualiseren de structuur van de belangrijkste DNA-reparatiecomponent met een bijna-atomaire resolutie Hoe traangas werkt
Hoe traangas werkt  Verre reuzenplaneten vormen anders dan mislukte sterren
Verre reuzenplaneten vormen anders dan mislukte sterren Wat is de formule voor energie?
Wat is de formule voor energie?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

