
Wetenschap
Wat is de bindingshoek van acetyleen?
Dit is waarom:
* Structuur: Acetyleen heeft een lineaire structuur. De twee koolstofatomen zijn drievoudig gebonden aan elkaar, en elk koolstofatoom is ook enkele gebonden aan een waterstofatoom.
* Hybridisatie: De koolstofatomen in acetyleen worden SP gehybridiseerd. Dit betekent dat elk koolstofatoom twee SP -hybride orbitalen en twee niet -gehybridiseerde P -orbitalen heeft.
* Bondvorming:
* De twee SP -hybride orbitalen op elk koolstofatoom vormen de σ -bindingen aan de andere koolstof en het waterstofatoom.
* De twee niet-gehybridiseerde P-orbitalen op elk koolstofatoom overlappen naast elkaar om twee π-bindingen te vormen, wat resulteert in de drievoudige binding tussen de koolstofatomen.
* lineariteit: De SP -hybride orbitalen liggen op 180 ° aan elkaar en de P -orbitalen zijn ook op een lineaire manier uitgelijnd. Dit leidt tot een lineaire moleculaire geometrie met een bindingshoek van 180 °.
 Hawaï-lava kruist belangrijke snelweg, vernietigt elektriciteitspalen
Hawaï-lava kruist belangrijke snelweg, vernietigt elektriciteitspalen Klimaatverandering:kinderen veroveren een plaats in de politiek, nu moeten volwassenen luisteren en handelen
Klimaatverandering:kinderen veroveren een plaats in de politiek, nu moeten volwassenen luisteren en handelen Wat zijn connotaties van licht?
Wat zijn connotaties van licht?  Middellandse Zee wordt geconfronteerd met hevigere hittegolven, droogte, branden:VN-conceptrapport
Middellandse Zee wordt geconfronteerd met hevigere hittegolven, droogte, branden:VN-conceptrapport Het lokale bergklimaat wordt beïnvloed door de bladoppervlakteverhouding in de omliggende bossen
Het lokale bergklimaat wordt beïnvloed door de bladoppervlakteverhouding in de omliggende bossen
Hoofdlijnen
- Wat beschrijft een hypothese?
- Kleine gouden sondes geven wetenschappers een idee van hoe ziekten zich ontwikkelen
- Is Siesmology een tak van biologie?
- Cyanobacteriële studies onderzoeken de celstructuur tijdens stikstofgebrek
- Ecologie: definitie, soorten, belang en voorbeelden
- Heeft het herschikken van chromosomen invloed op hun functie?
- Nieuwe liaansoorten gemeld uit Tibet
- Wetenschap van functies menselijk lichaam?
- Wat is een horminide?
- Bacteriële enzymen gekaapt om complexe moleculen te maken die normaal door planten worden gemaakt
- Elektronische chip bootst de hersenen na om in een flits herinneringen te maken

- Biochemici richten zich op de belangrijkste moleculen die cellen in staat stellen te kruipen
- Het visualiseren van de warmtestroom in bamboe kan helpen bij het ontwerpen van meer energie-efficiënte en brandveilige gebouwen

- Elektronenoverdracht en oxidatieve schade in DNA in een biomimetische crowding-omgeving
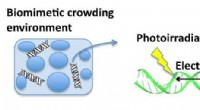
 Verschil tussen de beweging van deeltjes in een vaste en vloeistof?
Verschil tussen de beweging van deeltjes in een vaste en vloeistof?  Wat is energiebandtheorie?
Wat is energiebandtheorie?  Waar zijn de jongste rotsen in de Atlantische Oceaan?
Waar zijn de jongste rotsen in de Atlantische Oceaan?  Waarom zie ik alleen de helft van de maan overdag?
Waarom zie ik alleen de helft van de maan overdag?  Wanneer de hoeveelheid energie die een geluid draagt afneemt, wat gaat er nog meer af?
Wanneer de hoeveelheid energie die een geluid draagt afneemt, wat gaat er nog meer af?  Waar gaat astrobiologie mee om?
Waar gaat astrobiologie mee om?  Hoeveel protonen heeft één atoom van element natrium?
Hoeveel protonen heeft één atoom van element natrium?  NASA's Lucy strekt zijn vleugels uit in een succesvolle test voor de implementatie van zonnepanelen
NASA's Lucy strekt zijn vleugels uit in een succesvolle test voor de implementatie van zonnepanelen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

