
Wetenschap
Wat is de kleine massa -eenheid die wordt gebruikt om gewichtsatomen te labelen?
De kleine massa -eenheid die wordt gebruikt om het gewicht van atomen te labelen, is de atomaire massa -eenheid (AMU) .
Dit is waarom het belangrijk is:
* Atomen zijn ongelooflijk klein: Hun massa's zijn te klein om uit te drukken in gram of kilogrammen.
* Relatieve vergelijking: De AMU stelt ons in staat om gemakkelijk de massa's van verschillende atomen te vergelijken. Eén AMU wordt gedefinieerd als 1/12e de massa van een koolstof-12-atoom.
* Handige schaal: De meeste atomen hebben atomaire massa's dicht bij hele getallen, waardoor het gemakkelijk is om mee te werken.
Een waterstofatoom heeft bijvoorbeeld een atoommassa van ongeveer 1 AMU, terwijl een zuurstofatoom een atoommassa van ongeveer 16 AMU heeft.
 Volgens de Gibbs Free Energy -vergelijking Wat is het temperatuurbereik voor welke vorming van vloeibare broom spontaan?
Volgens de Gibbs Free Energy -vergelijking Wat is het temperatuurbereik voor welke vorming van vloeibare broom spontaan?  Van welke condensors zijn gemaakt?
Van welke condensors zijn gemaakt?  Snelle screeningmachine kan eiwitsequenties lezen en scheiden
Snelle screeningmachine kan eiwitsequenties lezen en scheiden Wat is CAP -fenomenen?
Wat is CAP -fenomenen?  Wetenschappers bereiken eerste totale synthese van potentieel anti-reumatisch sesquiterpeen merillianine
Wetenschappers bereiken eerste totale synthese van potentieel anti-reumatisch sesquiterpeen merillianine
 Kleine elektrische ladingen kunnen vliegtuigen helpen blikseminslagen te vermijden
Kleine elektrische ladingen kunnen vliegtuigen helpen blikseminslagen te vermijden Waarom vleermuizen tegen muren vliegen
Waarom vleermuizen tegen muren vliegen  Simulaties suggereren dat arme tropische regio's waarschijnlijk meer te lijden zullen hebben van de opwarming van de aarde
Simulaties suggereren dat arme tropische regio's waarschijnlijk meer te lijden zullen hebben van de opwarming van de aarde Hoe voedselkeuzes de planeet kunnen helpen
Hoe voedselkeuzes de planeet kunnen helpen Bestrijding van 18 branden, Californië kan het ergste brandseizoen tegemoet gaan
Bestrijding van 18 branden, Californië kan het ergste brandseizoen tegemoet gaan
Hoofdlijnen
- Amoebas cilliates flagellates and sporozoans are collectively called?
- Wat voedt de invasiestrategie van Salmonella?
- Hoe worden hormonen door het lichaam getransporteerd?
- Welke dieren verspreiden zaden?
- Nieuw onderzoek laat zien hoe sommige kippen gestreepte veren kregen
- Onderzoekers ontcijferen hoe een enzym het genetisch materiaal in de celkern wijzigt
- Welk type weefsel vormt het buitenste oppervlaktelichaam?
- Hoe stamcellen werken
- Wat zijn enkele voordelen voor het gebruik van een RNA -kopie van het gedeelte Het DNA -molecuul voor assemblage -aminozuren vormen eiwit in plaats daarvan het werkelijke molecuul?
- Nieuwe Raman-methode vangt doelmoleculen actief in kleine openingen
- De allereerste video met atomaire resolutie van zoutkristallen die zich in realtime vormen

- Robotbloedhond volgt geuren op de grond

- Video:De kunst en wetenschap van glasblazen

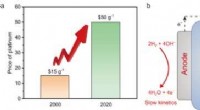
- Goedkope legering concurreert met duur platina om brandstofcellen te stimuleren
 Israëls eerste ruimtevaartuig naar de maan stuurt selfie
Israëls eerste ruimtevaartuig naar de maan stuurt selfie Fabricage van metamoleculen metamaterialen met 3D-co-assemblage
Fabricage van metamoleculen metamaterialen met 3D-co-assemblage  Wetenschappers verkrijgen grafeen met een hoge weerstand tegen ozonisatie
Wetenschappers verkrijgen grafeen met een hoge weerstand tegen ozonisatie Nieuwe met lucht gevulde vezelbundel kan endoscopen kleiner maken
Nieuwe met lucht gevulde vezelbundel kan endoscopen kleiner maken De toevoeging van A verhoogt de snelheidsreactie door een alternatieve route te bieden met lagere activeringsenergie?
De toevoeging van A verhoogt de snelheidsreactie door een alternatieve route te bieden met lagere activeringsenergie?  Economische onzekerheid is groot nu de effecten van het coronavirus escaleren
Economische onzekerheid is groot nu de effecten van het coronavirus escaleren Hoeveel chlooratomen zou een siliconenatoom ermee moeten vormen zodat het stabiel is?
Hoeveel chlooratomen zou een siliconenatoom ermee moeten vormen zodat het stabiel is?  Wat is het belang van standaardeenheden in het dagelijks leven?
Wat is het belang van standaardeenheden in het dagelijks leven?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

