
Wetenschap
Wanneer opgeloste deeltjes worden toegevoegd aan een zuiver oplosmiddel in gesloten container bij constante temperatuur en de dampdruk drukken?
Dit is waarom:
* dampdruk: De dampdruk van een vloeistof is de druk die wordt uitgeoefend door zijn damp wanneer de vloeistof en damp in evenwicht zijn.
* Interacties opgeloste oplosmiddel: Wanneer een opgeloste stof aan een oplosmiddel wordt toegevoegd, werken de opgeloste deeltjes samen met de oplosmiddelmoleculen. Deze interacties kunnen sterker of zwakker zijn dan de oplosmiddel-oplosmiddelinteracties.
* Verminderd oppervlak van het oplosmiddel: De aanwezigheid van opgeloste deeltjes vermindert het oppervlak van het oplosmiddel dat wordt blootgesteld aan de dampfase.
* Lagere ontsnappingssnelheid: Met een verminderd oppervlak en sterkere interacties hebben de oplosmiddelmoleculen een lagere kans om te ontsnappen in de dampfase, wat resulteert in een lagere dampdruk.
de wet van Raoult stelt dat de gedeeltelijke dampdruk van een oplosmiddel in een oplossing gelijk is aan de dampdruk van het zuivere oplosmiddel vermenigvuldigd met de molfractie van het oplosmiddel in de oplossing:
* p oplossing =X oplosmiddel * P oplosmiddel
waar:
* P oplossing is de dampdruk van de oplossing
* X oplosmiddel is de molfractie van het oplosmiddel in de oplossing
* P oplosmiddel is de dampdruk van het pure oplosmiddel
Belangrijke opmerking: Deze verklaring veronderstelt een ideale oplossing, waarbij de opgeloste en oplosmiddelmoleculen op dezelfde manier op elkaar inwerken. In real-world scenario's kunnen afwijkingen van de wet van Raoult optreden.
 Wat gebeurt er met de materialen wanneer het is afgekoeld?
Wat gebeurt er met de materialen wanneer het is afgekoeld?  Hoeveel elektronen heeft elk mangaanatoom verloren om MNCO3 te maken?
Hoeveel elektronen heeft elk mangaanatoom verloren om MNCO3 te maken?  Als citroenzuur 6 koolstofatomen heeft, hoeveel worden er in netigzuur aangetroffen?
Als citroenzuur 6 koolstofatomen heeft, hoeveel worden er in netigzuur aangetroffen?  Welke verbinding maakt tin -koolstof en zuurstof?
Welke verbinding maakt tin -koolstof en zuurstof?  Als twee chemicaliën bij elkaar worden toegevoegd in een beker en de verkoudheid is die chemische reactie?
Als twee chemicaliën bij elkaar worden toegevoegd in een beker en de verkoudheid is die chemische reactie?
 De tevredenen zullen de aarde erven. De sombere? Niet zo veel
De tevredenen zullen de aarde erven. De sombere? Niet zo veel  Wat in de wetenschap moet worden gemaakt of gecreëerd als vergelijkbaar mogelijk als het echte werk?
Wat in de wetenschap moet worden gemaakt of gecreëerd als vergelijkbaar mogelijk als het echte werk?  Vier geografische factoren die van invloed zijn op cultuur
Vier geografische factoren die van invloed zijn op cultuur Waarom de veranderende kleur van straatverlichting een gevaar kan zijn voor insectenpopulaties
Waarom de veranderende kleur van straatverlichting een gevaar kan zijn voor insectenpopulaties  Vrees voor de toekomst van de groene long van Mexico-Stad
Vrees voor de toekomst van de groene long van Mexico-Stad
Hoofdlijnen
- Studie:Baby Kinda bavianen worden sneller onafhankelijk als moeders sociaal en dominant zijn
- De theorie verklaart waarom 25 procent van de culturen mannelijke geslachtsdelen afsnijdt
- Hoe honden en katten hun dag in de rechtbank kunnen krijgen
- Wie ontdekte de celreproductie?
- Wat is een wetenschappelijke definitie voor bewijs?
- Sla, kool voor zeekoeien? Feds en natuurbeschermers overwegen om zeekoeien te voeren na 1.000 doden
- Salamander-genoom geeft aanwijzingen over uniek regeneratief vermogen
- Wat voor zelfstandig naamwoord is groei?
- Hoe wordt de wetenschap gebruikt in paleontologie?
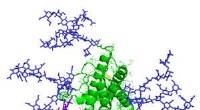
- In kaart brengen en meten van eiwitten op de oppervlakken van endoplasmatisch reticulum (ER) in cellen

- Onderzoek onthult de chemische onderbouwing van hoe goedaardig water kan veranderen in hard waterstofperoxide

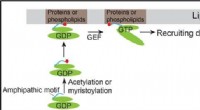
- Onderzoekers ontdekken een nieuw mechanisme voor het werven van ARF-familie-eiwitten
- Het lichaam vertrouwt op duizenden suiker-eiwitcomplexen om gezond te blijven
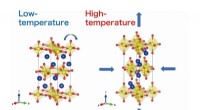
- Studie onderzoekt opmerkelijke negatieve thermische uitzetting gezien in gelaagde ruthenaten
 Is er ooit iemand op de zon geland?
Is er ooit iemand op de zon geland?  Bibliotheken kunnen 3D-printers hebben, maar ze gaan nog steeds over boeken
Bibliotheken kunnen 3D-printers hebben, maar ze gaan nog steeds over boeken Grote hoeveelheden antimicrobiële stoffen in Zweedse rioolwaterzuiveringsinstallaties
Grote hoeveelheden antimicrobiële stoffen in Zweedse rioolwaterzuiveringsinstallaties Wat verwijst naar de conversie van de ene vorm -energie in de andere?
Wat verwijst naar de conversie van de ene vorm -energie in de andere?  Wat is de betekenis van Word Life Science?
Wat is de betekenis van Word Life Science?  Het mysterie van coronale verwarming
Het mysterie van coronale verwarming Waarom zou u elektriciteit besparen?
Waarom zou u elektriciteit besparen?  Wat is de milieu -impact van het gebruik van biomassa -energie?
Wat is de milieu -impact van het gebruik van biomassa -energie?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

