
Wetenschap
Wat ontdekte Ernest Rutherford over de structuur van een atoom?
* Het atoom heeft een dichte, positief geladen kern in het midden. Dit was in strijd met het heersende "pruimpuddingmodel" dat suggereerde dat de positieve lading gelijkmatig over het atoom was verdeeld. Rutherford merkte op dat de meeste alfa -deeltjes dwars door de gouden folie gingen, maar sommige werden onder grote hoeken afgebogen en een paar stuiterden zelfs terug. Dit suggereerde dat de positieve lading was geconcentreerd in een klein, dicht gebied, dat hij de kern noemde.
* Het grootste deel van het atoom is lege ruimte. Omdat de meeste alfa -deeltjes door de folie gingen zonder te worden afgebogen, concludeerde Rutherford dat het atoom meestal lege ruimte was, met elektronen rond de kern.
Deze ontdekking bracht een revolutie teweeg in ons begrip van het atoom en leidde tot de ontwikkeling van het planetaire model van het atoom , die elektronen afbeelden die rond de kern ronddraaien, zoals planeten die rond de zon draaien.
Hoewel het model van Rutherford een belangrijke verbetering was ten opzichte van eerdere modellen, werd het later verfijnd door Niels Bohr, die het concept van gekwantiseerde energieniveaus voor elektronen introduceerde.
 NASA ziet tropische storm Kai-Tak over de Filipijnen bewegen
NASA ziet tropische storm Kai-Tak over de Filipijnen bewegen Nieuwe studie toont dominantie aan van lokale bronnen van luchtvervuiling in Delhi
Nieuwe studie toont dominantie aan van lokale bronnen van luchtvervuiling in Delhi Welke twee belangrijke factoren kenmerken een terrestrisch ecosysteem?
Welke twee belangrijke factoren kenmerken een terrestrisch ecosysteem?  Bronnen van nieuwe ozonbeschadigende HCFK's terug te voeren tot hun oorsprong
Bronnen van nieuwe ozonbeschadigende HCFK's terug te voeren tot hun oorsprong Wat leidt tot verwering?
Wat leidt tot verwering?
Hoofdlijnen
- Wat is het bindweefsel onder tong dat verbindt met de onderkant van de mond die wordt genoemd?
- Wat zijn de kenmerken van aseksuele reproductie?
- Wat is de manier van voeding in bacteriën?
- Welke wordt gevonden in zowel RNA als DNA?
- Als een cel van een organisme nucleus bevat, is de eukaryote?
- Wat is het bijproduct van cellulaire ademhaling dat BTB geel verandert?
- Produceren de mens secundaire metabolieten?
- Menselijke anatomieprojecten
- Nieuwe techniek helpt te ontdekken of bacteriën die meningitis veroorzaken resistent zijn tegen antibiotica
- Lab creëert stoere, maar teder, kankerbestrijders
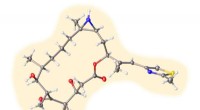
- Spinzijde sleutel tot nieuwe botfixerende composiet

- Chemische datamining stimuleert zoektocht naar nieuwe organische halfgeleiders

- Carbonitride-aerogels bemiddelen de fotokatalytische omzetting van water
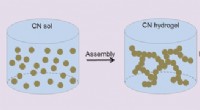
- Kwikzilver inhalen:MXene-materiaal kan kwikverontreiniging tegengaan

 Geen worm nodig:plastic walvis laat je naar afval vissen
Geen worm nodig:plastic walvis laat je naar afval vissen Leg uit hoe fotosynthetische organismen mensen ten goede komen?
Leg uit hoe fotosynthetische organismen mensen ten goede komen?  Leven op Mars? Nederlands bedrijf gaat enkele reizen naar de Rode Planeet aanbieden
Leven op Mars? Nederlands bedrijf gaat enkele reizen naar de Rode Planeet aanbieden  Erosie-effecten op het ecosysteem
Erosie-effecten op het ecosysteem  Doorbraak in microfabricage kan piëzo-elektrische materiaaltoepassingen in gang zetten
Doorbraak in microfabricage kan piëzo-elektrische materiaaltoepassingen in gang zetten Hoe neuronale activiteit leidt tot eiwitsplitsing bij Alzheimer
Hoe neuronale activiteit leidt tot eiwitsplitsing bij Alzheimer  Energie oogsten gaat biologisch, wordt flexibeler
Energie oogsten gaat biologisch, wordt flexibeler De helderste sterren hebben duidelijke magnitudes die zijn?
De helderste sterren hebben duidelijke magnitudes die zijn?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

