
Wetenschap
De moleculen van alle monsters ideale gassen hebben dezelfde gemiddelde kinetische energieën tegelijk?
De moleculen van alle ideale gassen hebben dezelfde gemiddelde kinetische energieën bij dezelfde *temperatuur *.
Dit is waarom:
* Kinetische energie en temperatuur: De gemiddelde kinetische energie van gasmoleculen is recht evenredig met de absolute temperatuur (gemeten in Kelvin). Hoe hoger de temperatuur, hoe sneller de moleculen bewegen en hoe hoger hun gemiddelde kinetische energie.
* Ideale gaswet: De ideale gaswet beschrijft het gedrag van ideale gassen en relateert druk, volume, temperatuur en het aantal mol gas. Een van de belangrijkste implicaties is dat bij een gegeven temperatuur de gemiddelde kinetische energie van gasmoleculen hetzelfde is, ongeacht het type gas.
Sleutelpunten:
* ideaal gas: Een ideaal gas is een theoretisch construct dat veronderstelt dat er geen intermoleculaire krachten zijn en dat het volume van de gasmoleculen te verwaarlozen is in vergelijking met het volume van de container. Echte gassen wijken af van ideaal gedrag, vooral bij hoge drukken en lage temperaturen.
* Gemiddelde kinetische energie: De gemiddelde kinetische energie verwijst naar het gemiddelde van de kinetische energieën van alle gasmoleculen in het monster. Niet alle moleculen zullen op een bepaald moment dezelfde kinetische energie hebben, maar het gemiddelde zal hetzelfde zijn voor alle ideale gassen bij dezelfde temperatuur.
Laat het me weten als je nog andere vragen hebt!
 Verband tussen continentaal uiteenvallen, vulkanische koolstofemissies en evolutie
Verband tussen continentaal uiteenvallen, vulkanische koolstofemissies en evolutie Wat is een subtropische storm en hoe verschilt deze van een tropisch of extratropisch systeem?
Wat is een subtropische storm en hoe verschilt deze van een tropisch of extratropisch systeem?  Wat is het meest voorkomende element in de aarde?
Wat is het meest voorkomende element in de aarde?  Wat is het verschil tussen satellietbeelden en luchtfotografie?
Wat is het verschil tussen satellietbeelden en luchtfotografie?  Op Antartica, de kleine voetafdruk van de mensheid heeft een grote impact
Op Antartica, de kleine voetafdruk van de mensheid heeft een grote impact
Hoofdlijnen
- Mariene wetenschappers leiden een uitgebreide beoordeling van soorten reuzenschelpdieren wereldwijd
- Wat zijn de lagen op buiten een celmembraan genoemd?
- Wat is de oorsprong van bacteriën?
- Wat zijn vijf eigenschappen die de meeste organismen hebben?
- Wat is transcriptie en wat zijn de belangrijkste stappen in dit proces?
- Hoe de ijstijden de evolutie van de vreemde en stugge inheemse planten in Nieuw-Zeeland hebben gestimuleerd
- Wat is een voorbeeld van mitochondria?
- In het blauw:hoe baleinwalvissen zich de afgelopen 50 miljoen jaar hebben aangepast
- Wat is een verklaring van de wetenschappelijke methode?
- Wetenschappers gebruiken tabaksafvalvloeistof en ijzerafval voor het verwijderen van Cd(II)
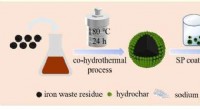
- Efficiënte perovskiet fotovoltaïsche energie optimaliseren

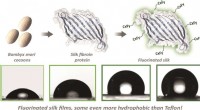
- Wetenschappers gebruiken gemodificeerde zijde-eiwitten om nieuwe anti-aanbakoppervlakken te creëren
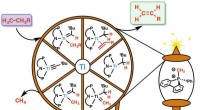
- Goedkoop, energiezuinige en schone reactie om chemische grondstof te maken
- Licht biedt controle voor 3D-printen met meerdere materialen

 Welke uren werken geologische ingenieurs?
Welke uren werken geologische ingenieurs?  Welke kleur maakt waterstofchloride vochtige lakmoespapier?
Welke kleur maakt waterstofchloride vochtige lakmoespapier?  Welke stoffen maken koolstofdioxide?
Welke stoffen maken koolstofdioxide?  Tienduizenden trekken over ruig pad om een glimp op te vangen van de IJslandse vulkaan
Tienduizenden trekken over ruig pad om een glimp op te vangen van de IJslandse vulkaan Worden haaien aangevallen door orka's voor de kust van Kaapstad?
Worden haaien aangevallen door orka's voor de kust van Kaapstad?  NASA:mysterieus object is 54 jaar oude raket niet asteroïde
NASA:mysterieus object is 54 jaar oude raket niet asteroïde Een platform voor mobiele innovators in Afrika
Een platform voor mobiele innovators in Afrika Hoe vind je kinetische energie als er geen definitieve snelheid wordt gegeven?
Hoe vind je kinetische energie als er geen definitieve snelheid wordt gegeven?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

