
Wetenschap
Waarom hebben alkalimetaal een lage ionisatie -energie?
* Grote atoomradius: Alkali -metalen hebben een enkele valentie -elektron in hun buitenste schaal, en dit elektron is relatief ver van de kern vanwege hun grote atoomstralen. Deze afstand verzwakt de elektrostatische aantrekkingskracht tussen de kern en het valentie -elektron, waardoor het gemakkelijker te verwijderen is.
* Zwakke nucleaire lading: De effectieve nucleaire lading ervaren door het valentie -elektron is laag. Dit komt omdat de binnenste schaal elektronen het valentie -elektron beschermen tegen de volledige positieve lading van de kern. Hoe zwakker de aantrekkingskracht, hoe gemakkelijker het is om het elektron te verwijderen.
* Elektron met één valentie: Het hebben van slechts één valentie-elektron betekent dat het minder strak wordt vastgehouden en ervaart minder elektron-elektronenafstoting in vergelijking met elementen met meerdere valentie-elektronen.
Deze factoren combineren om alkali -metalen zeer reactief te maken en vormen gemakkelijk kationen door hun enkele valentie -elektron te verliezen.
Hier is een eenvoudige analogie:stel je een ballon voor aan een touwtje. Hoe verder de ballon van het touw is, hoe zwakker de kracht die het vasthoudt. Evenzo is hoe verder het valentie -elektron afkomstig is van de kern (vanwege grote atoomradius), hoe zwakker de aantrekkingskracht en gemakkelijker het is om te verwijderen.
Hoofdlijnen
- Wat vormt het polypeptide -alanine?
- Hoe de 3D-structuur van ooglenseiwitten wordt gevormd
- Treedt op wanneer soorten die vergelijkbaar waren, steeds onderscheider worden?
- Geneesmiddelresistentie uit schimmels verdrijven
- Parasieten klaar om te springen:hoe de cel mobiele genetische elementen onderdrukt
- Doorbraak in het begrijpen hoe stamcellen zich specialiseren
- Wie controleert wie:Algen of zeeanemoon?
- Wat is de manier van overerving -syndroom?
- Welke rollen hebben alle soorten weefsel?
- Een kaart van reacties helpt bij het controleren van moleculaire eigenschappen
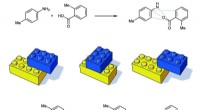
- Voordelige, herbruikbare Mn-katalysatoren zorgen voor een efficiënte alkylering van ketonen met alcoholen
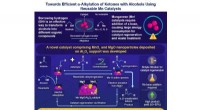
- Ontwerpstrategie op moleculair niveau kan de sleutel zijn tot het stimuleren van commerciële waterstofproductie
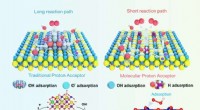
- Zuur kan een belangrijk ingrediënt zijn voor een betere kleefkracht, elektronische componenten

- Een systeem voor vroegtijdige waarschuwing voor schade in composietmaterialen

 SLAC's nieuwe röntgenbundellijn helpt COVID-19-onderzoek
SLAC's nieuwe röntgenbundellijn helpt COVID-19-onderzoek Wat is de kracht tussen twee ladingdeeltje wanneer het medium ze plaatste?
Wat is de kracht tussen twee ladingdeeltje wanneer het medium ze plaatste?  Elon Musk lanceert een Tesla de ruimte in – zo gaat SpaceX dat doen
Elon Musk lanceert een Tesla de ruimte in – zo gaat SpaceX dat doen  Team bewijst het concept van een natuurlijke benadering van anti-transpiranten
Team bewijst het concept van een natuurlijke benadering van anti-transpiranten Wat is de chemische formule van siliciumdioxide octahydraat?
Wat is de chemische formule van siliciumdioxide octahydraat?  Nieuwe manieren waarop wetenschappers kunnen helpen wetenschap terug in de populaire cultuur te brengen
Nieuwe manieren waarop wetenschappers kunnen helpen wetenschap terug in de populaire cultuur te brengen Is er eindelijk meer hulp in de strijd tegen robocalls?
Is er eindelijk meer hulp in de strijd tegen robocalls? Law of Segregation (Mendel): definitie, toelichting en voorbeelden
Law of Segregation (Mendel): definitie, toelichting en voorbeelden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


