
Wetenschap
Hoe worden elektronen in Atom georganiseerd?
1. Energieniveaus:
* Elektronen bestaan in verschillende energieniveaus, ook bekend als elektronenschalen. Deze schelpen worden aangeduid met getallen (1, 2, 3, enz.) Met hogere getallen die een hogere energieniveaus aangeven.
* Elektronen in hetzelfde energieniveau hebben vergelijkbare energie, maar ze kunnen verder worden onderverdeeld in subshells.
2. Subshells:
* Binnen elk energieniveau zijn er subshells aangegeven door letters (s, p, d, f).
* Elke subshell kan een specifiek aantal elektronen bevatten:
* S Subshell:bevat maximaal 2 elektronen
* P Subshell:bevat maximaal 6 elektronen
* D Subshell:bevat maximaal 10 elektronen
* f Subshell:bevat maximaal 14 elektronen
3. Orbitalen:
* Elke subshell bestaat uit orbitalen, die regio's van de ruimte vertegenwoordigen waar een grote kans is om een elektron te vinden.
* De vorm en het aantal orbitalen zijn afhankelijk van de subshell:
* S Subshell:1 sferisch orbitaal
* P Subshell:3 Dumbbell-vormige orbitalen
* D Subshell:5 complexe orbitalen
* F Subshell:7 nog complexere orbitalen
4. Het AUFBAU -principe en de regel van Hund:
* AUFBAU -principe: Elektronen vullen eerst de laagste energieniveaus.
* Hund's Rule: Binnen een subshell vullen elektronen orbitalen afzonderlijk voordat ze in hetzelfde orbitaal worden gekoppeld. Dit zorgt voor maximale spin -multipliciteit, waardoor het atoom stabieler wordt.
5. Elektronenconfiguratie:
* De elektronenconfiguratie van een atoom beschrijft de verdeling van elektronen tussen de verschillende energieniveaus, subshells en orbitalen.
* De elektronenconfiguratie van koolstof is bijvoorbeeld 1S²2S²2P². Dit betekent dat koolstof twee elektronen heeft in het eerste energieniveau (1S), twee in het tweede energieniveau (2S) en twee in de P -subshell van het tweede energieniveau (2P).
Samenvattend:
Elektronen in een atoom zijn georganiseerd in een hiërarchische structuur van energieniveaus, subshells en orbitalen. Deze regels en principes bepalen de unieke eigenschappen van elk element en hoe ze omgaan met andere atomen.
 Is benzine hetzelfde als benzeen?
Is benzine hetzelfde als benzeen?  Waarom bestaat fluor als een diatomee molecuul?
Waarom bestaat fluor als een diatomee molecuul?  Wat is de vergelijking van kwiknitraat en lithiumchloride gemengd in een testbuis?
Wat is de vergelijking van kwiknitraat en lithiumchloride gemengd in een testbuis?  Welke toestemming van 2 of meer atomen hebben zich aangesloten in een duidelijke verhouding?
Welke toestemming van 2 of meer atomen hebben zich aangesloten in een duidelijke verhouding?  Welke elementen worden gebruikt om verbindingen te vormen?
Welke elementen worden gebruikt om verbindingen te vormen?
 Natuurrampen moeten ongebruikelijk of dodelijk zijn om een verandering van het lokale klimaatbeleid teweeg te brengen, studie vondsten
Natuurrampen moeten ongebruikelijk of dodelijk zijn om een verandering van het lokale klimaatbeleid teweeg te brengen, studie vondsten De regenwouddieren die metamorfose ondergaan
De regenwouddieren die metamorfose ondergaan
Het regenwoud beslaat slechts 6 procent van 's werelds tropische gebieden, maar ze zijn de thuisbasis van meer dan de helft van de soorten dieren in de wereld. Sommige van deze dieren ondergaan een metam
 Hoe aerosolen ons klimaat beïnvloeden
Hoe aerosolen ons klimaat beïnvloeden Hoe mensen, voedsel en water de grote verspreiding van herbivoren in Oost-Afrikaanse savannes beïnvloeden
Hoe mensen, voedsel en water de grote verspreiding van herbivoren in Oost-Afrikaanse savannes beïnvloeden  Ontbossing Braziliaanse Amazone bereikt record in april
Ontbossing Braziliaanse Amazone bereikt record in april
Hoofdlijnen
- Hoe het Jeruzalem-syndroom werkt
- Hoe heten de cellen in neus en keel die stofdeeltjes opvangen?
- Verklaring om rekening te houden met vele soorten waarnemingen?
- Hoe wordt een biologische productiviteit gemeten?
- Waar zijn de genetische materialenchromosomen opgeslagen in planten- en dierlijke cel?
- Wat zijn arachnoïden?
- Hoe een bio-bot te bouwen:Onderzoekers delen het ontwerp en de ontwikkeling van biologische machines
- Welke microbe is Peneilline?
- Dieren en mensen:een valse kloof?
- Gemodificeerd enzym dat wordt gebruikt voor een betere anti-Markovnikov-selectiviteit bij alkeenoxidaties
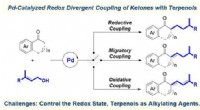
- Nieuwe strategie ontwikkeld voor redox divergente koppeling van ketonen met terpenen
- Een methode om kristallen te construeren met een grote fractie reactieve facetten

- Ongrijpbare verbindingen van broeikasgas geïsoleerd

- Kooldioxide binden met gebroken beton

 Het totale aantal verduistering elk jaar is niet hoger dan?
Het totale aantal verduistering elk jaar is niet hoger dan?  Wat is de snelheid van ultrasone golven in tolueen?
Wat is de snelheid van ultrasone golven in tolueen?  Wat is de energie in EV van rood licht?
Wat is de energie in EV van rood licht?  Hoeveel neutronen in zwavel?
Hoeveel neutronen in zwavel?  Wie heeft het atoommodel uitgevonden?
Wie heeft het atoommodel uitgevonden?  Wat zijn hoekpunten in wiskunde?
Wat zijn hoekpunten in wiskunde?  Is de wet van toepassing op stroperige vloeistoffen?
Is de wet van toepassing op stroperige vloeistoffen?  Een koolstof kan enkele en dubbele drievoudige bindingen met elkaar vormen, dus waarom geen quad-binding?
Een koolstof kan enkele en dubbele drievoudige bindingen met elkaar vormen, dus waarom geen quad-binding?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

