
Wetenschap
Wat neemt moleculen elke beschikbare ruimte in beslag?
* moleculen hebben volume: Moleculen zijn geen oneindig kleine punten. Ze hebben een specifieke grootte en vorm. Dit betekent dat ze een bepaald volume ruimte innemen.
* intermoleculaire krachten: De manier waarop moleculen met elkaar omgaan (door krachten zoals van der Waals -krachten of waterstofbinding) beïnvloedt hoeveel ruimte ze innemen.
* in vaste stoffen: Moleculen zijn nauw aan elkaar verpakt, waardoor minimale vrije ruimte achterblijft.
* in vloeistoffen: Moleculen zijn losjes verpakt, waardoor meer vrije ruimte mogelijk is.
* in gassen: Moleculen zijn ver uit elkaar, met veel vrije ruimte ertussen.
* Compressibiliteit: Gassen zijn zeer samendrukbaar omdat er veel lege ruimte is tussen de moleculen. Vaste stoffen zijn minder samendrukbaar omdat hun moleculen strak zijn verpakt. Vloeistoffen vallen ergens tussenin.
Daarom bezetten moleculen ruimte, maar de hoeveelheid ruimte die ze innemen, hangt af van de toestand van materie en de sterkte van intermoleculaire krachten.
Het is belangrijk om dit te onderscheiden van het idee van diffusie , waar moleculen bewegen om de beschikbare ruimte te vullen. Hoewel diffusie moleculen inhoudt die zich bewegen, betekent dit niet dat ze alle beschikbare ruimte innemen.
Laat het me weten als je nog andere vragen hebt!
 Waarom is een koolstof-dubbele binding niet twee keer zo sterk enkelvoudige binding?
Waarom is een koolstof-dubbele binding niet twee keer zo sterk enkelvoudige binding?  Hoe beïnvloedt de pH de ionische binding?
Hoe beïnvloedt de pH de ionische binding?  Wat is de oplosbaarheid van natriumjodide in water?
Wat is de oplosbaarheid van natriumjodide in water?  Wat is pseudo-vast in de chemie?
Wat is pseudo-vast in de chemie?  Röntgenfoto's laten zien hoe perioden van stress een ijstijdhyena tot op het bot veranderden
Röntgenfoto's laten zien hoe perioden van stress een ijstijdhyena tot op het bot veranderden
 Aardse lavabuizen kunnen inzicht bieden in buitenaards leven
Aardse lavabuizen kunnen inzicht bieden in buitenaards leven Studie bevestigt meer media-aandacht voor klimaatverandering gewenst
Studie bevestigt meer media-aandacht voor klimaatverandering gewenst Van verstrikking tot invasies van uitheemse soorten - de schade veroorzaakt door zwerfvuil op zee
Van verstrikking tot invasies van uitheemse soorten - de schade veroorzaakt door zwerfvuil op zee Veranderingen in regenval en temperaturen hebben al invloed gehad op de waterkwaliteit
Veranderingen in regenval en temperaturen hebben al invloed gehad op de waterkwaliteit Een boom-mendous studie:biomassa uit bosherstel
Een boom-mendous studie:biomassa uit bosherstel
Hoofdlijnen
- Welke organen zijn aan uw recht?
- De gevaarlijkste gebieden voor aanvaringen met schepen met walvishaaien onthuld
- Wat zijn de takken van voedselwetenschap?
- Genetische redding bevordert het herstel van de met uitsterven bedreigde Australische dwergbuidelmuizen
- Wat produceren zoogdieren dat planten gebruiken?
- Bacteriecellen reproduceren aseksueel door wat?
- Hoe tanden de levensboom verklaren
- Wat zijn de negatieve effecten van hybridisatie?
- DNA versus RNA: wat zijn de overeenkomsten en verschillen? (met diagram)
- Nieuwe trucjes leren van zeesponzen, naturen meest onwaarschijnlijke civiel ingenieurs

- Onderzoekers bootsen twee natuurlijke energieprocessen na met een enkele katalysator
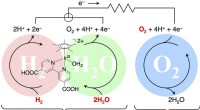
- Wetenschappers ontwikkelen moleculaire thermometer voor contactloze metingen met infraroodlicht

- Vooruitgang in de richting van een nieuwe griepbehandeling, dankzij een kleine aanpassing
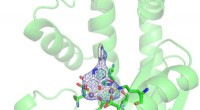
- Video:Wat is leven? En zullen we het op andere planeten vinden?

 Een stof kan warmte -energie absorberen door het proces van?
Een stof kan warmte -energie absorberen door het proces van?  De gouden eeuw van de sociale wetenschappen
De gouden eeuw van de sociale wetenschappen Hoeveel atomen zijn er in 1,008 gram waterstof?
Hoeveel atomen zijn er in 1,008 gram waterstof?  Wat is het bioom dat het minste hoeveelheid regenval ontvangt?
Wat is het bioom dat het minste hoeveelheid regenval ontvangt?  Facebook sluit 583 miljoen nepaccounts
Facebook sluit 583 miljoen nepaccounts Is zonne -energie een voordeel of een nadeel?
Is zonne -energie een voordeel of een nadeel?  Worden tornado's sterker?
Worden tornado's sterker?  Wat zijn de meest voorkomende sterren in onze melkweg, en hoe dragen ze bij aan de algehele structuurdynamiek van Melkweg?
Wat zijn de meest voorkomende sterren in onze melkweg, en hoe dragen ze bij aan de algehele structuurdynamiek van Melkweg?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

