
Wetenschap
Waarom is natriumfluoride een ionische binding?
* elektronegativiteit: Fluor is het meest elektronegatieve element, wat betekent dat het een sterke aantrekkingskracht heeft op elektronen. Natrium daarentegen heeft een lage elektronegativiteit. Dit verschil in elektronegativiteit leidt tot een overdracht van elektronen.
* elektronenoverdracht: Wanneer natrium en fluor reageren, verwijdert het sterk elektronegatieve fluoratoom het elektron van enkele valentie volledig uit het natriumatoom. Dit resulteert in de vorming van een positief geladen natriumion (Na+) en een negatief geladen fluoride-ion (F-).
* Elektrostatische aantrekkingskracht: De tegengesteld geladen ionen, Na+ en F-, worden vervolgens tot elkaar aangetrokken vanwege elektrostatische krachten, waardoor een ionische binding wordt gevormd.
Samenvattend: Het grote verschil in elektronegativiteit tussen natrium en fluor veroorzaakt een elektronenoverdracht, wat resulteert in de vorming van tegengesteld geladen ionen die bij elkaar worden gehouden door elektrostatische krachten, waardoor een ionische binding wordt gedefinieerd.
 Goedkoop, schaalbare watersplitsing voedt de toekomstige waterstofeconomie
Goedkoop, schaalbare watersplitsing voedt de toekomstige waterstofeconomie Zwavel wordt vaak in de natuur gevonden als een element dat niet wordt gecombineerd met andere elementen een verbinding. Wat vertelt dit feit u over de reactiviteit van zwavel?
Zwavel wordt vaak in de natuur gevonden als een element dat niet wordt gecombineerd met andere elementen een verbinding. Wat vertelt dit feit u over de reactiviteit van zwavel?  Beschrijf de stappen in een wetenschappelijke methode?
Beschrijf de stappen in een wetenschappelijke methode?  Is fenylacetaat of boterzuur polairer?
Is fenylacetaat of boterzuur polairer?  Hoe wordt het protonnummer genoemd als u verwijst naar de periodieke tabel?
Hoe wordt het protonnummer genoemd als u verwijst naar de periodieke tabel?
 NASA-satellieten spotten eerste Atlantische subtropische storm
NASA-satellieten spotten eerste Atlantische subtropische storm Deze mijn in Alaska zou $1 miljard per jaar kunnen genereren. Is het het risico voor zalm waard?
Deze mijn in Alaska zou $1 miljard per jaar kunnen genereren. Is het het risico voor zalm waard?  Wetenschappers bieden routekaart aan om milieuobservaties in de Indische Oceaan te verbeteren
Wetenschappers bieden routekaart aan om milieuobservaties in de Indische Oceaan te verbeteren Copernicus 20 jaar later
Copernicus 20 jaar later Landen moeten samenwerken aan verwijdering van kooldioxide om gevaarlijke klimaatverandering te voorkomen
Landen moeten samenwerken aan verwijdering van kooldioxide om gevaarlijke klimaatverandering te voorkomen
Hoofdlijnen
- Welke wetenschapper gebruikte kolven om de biogenese theorie te ondersteunen?
- Waarom kiezen voor biotechnologie?
- Modellen beginnen te ontrafelen hoe afzonderlijke DNA-strengen combineren
- Hoe worden cellen gerangschikt van de kleinste naar de grootste?
- Chimpansees kunnen leren gereedschap te gebruiken zonder anderen te observeren
- Wat zeggen wetenschapper als een probleem?
- Wetenschappers identificeren verborgen genetische variatie die de evolutie helpt stimuleren
- Bijt hierop:onderzoeker ontdekt dat alligators haaien eten
- Biologen ontdekken hoe belangrijke mechanismen voor de aanhechting van koolhydraten niet goed werken
- Begrijpen wat Tennessee whisky uniek maakt

- Een reeks stoffen met antitumoreigenschappen gesynthetiseerd
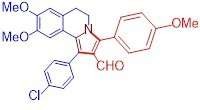
- Water-in-zoutelektrolyt levert stabiele kathode op voor lithium-luchtbatterijen

- Efficiënte katalysator op basis van titanium gebruikt om PEF te produceren, biobased alternatief voor PET

- Wetenschappers onthullen de structuur van virale rodopsines
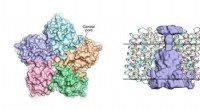
 Een relatie tussen streng winterweer en Arctische warmte?
Een relatie tussen streng winterweer en Arctische warmte? Wat is een grofkorrelig stollingsgesteente bestaande uit voornamelijk pyroxeen plagioclase veldspaat en olivine?
Wat is een grofkorrelig stollingsgesteente bestaande uit voornamelijk pyroxeen plagioclase veldspaat en olivine?  Welke hapoens naar de energie in een vloeistof als hij warmte afleverde?
Welke hapoens naar de energie in een vloeistof als hij warmte afleverde?  Hoe u uw familie en vrienden over het nieuwe IPCC-rapport kunt praten:vijf tips uit onderzoek naar communicatie over klimaatverandering
Hoe u uw familie en vrienden over het nieuwe IPCC-rapport kunt praten:vijf tips uit onderzoek naar communicatie over klimaatverandering  Wat zijn al het volgende manieren waarop sedimentaire rotsen zich vormen behalve A. lava koeling B. fysieke processen C. Chemical D. Bouw plant- en dierenresten?
Wat zijn al het volgende manieren waarop sedimentaire rotsen zich vormen behalve A. lava koeling B. fysieke processen C. Chemical D. Bouw plant- en dierenresten?  Welk zuur produceert chloride zouten?
Welk zuur produceert chloride zouten?  Zuckerberg centraal in Holocaust-ontkenningscontroverse (update)
Zuckerberg centraal in Holocaust-ontkenningscontroverse (update) Wat komt al het weer voor op het halfrond van de aarde?
Wat komt al het weer voor op het halfrond van de aarde?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

