
Wetenschap
Combineert waterstof met andere elementen?
* de unieke eigenschappen van waterstof: Waterstof heeft slechts één proton en één elektron. Dit maakt het zeer reactief, omdat het gemakkelijk een elektron wint of verliest om een stabiele configuratie te bereiken.
* soorten binding:
* Covalente binding: Waterstof deelt zijn elektron gemakkelijk met andere niet -metalen om covalente bindingen te vormen. Dit is hoe water (H₂o), methaan (ch₄) en ammoniak (NH₃) worden gevormd.
* ionische binding: Waterstof kan ook zijn elektron verliezen om een positief ion (H⁺) te vormen en vervolgens ionische bindingen te vormen met niet -metalen zoals chloor (HCl) of zuurstof (H₂O).
Hier zijn enkele voorbeelden van verbindingen gevormd door waterstof die combineren met andere elementen:
* water (h₂o): Gevormd door waterstof combineren met zuurstof.
* koolwaterstoffen (zoals methaan, ch₄): Gevormd door waterstof combineren met koolstof.
* zuren (zoals zoutzuur, HCl): Gevormd door waterstof combineren met halogenen (zoals chloor).
* ammoniak (NH₃): Gevormd door waterstof combineren met stikstof.
* alcoholen (zoals ethanol, c₂h₅oh): Gevormd door waterstof combineren met koolstof, zuurstof en soms andere elementen.
Samenvattend maken de kleine grootte, enkele elektron en hoge reactiviteit van waterstof het een veelzijdig element dat gemakkelijk combineert met andere elementen om een breed scala aan verbindingen te vormen.
 Wetenschappers werken aan biologisch afbreekbaar plastic van zonlicht
Wetenschappers werken aan biologisch afbreekbaar plastic van zonlicht Welk deel speelt water bij de absorptie van minerale zouten uit de grond?
Welk deel speelt water bij de absorptie van minerale zouten uit de grond?  Chemici bepalen hoe bijproducten bij de synthese van perovskieten kunnen worden vermeden
Chemici bepalen hoe bijproducten bij de synthese van perovskieten kunnen worden vermeden De eigenschappen van stoffen die kunnen worden waargenomen of gemeten zonder hun chemische identiteit te veranderen?
De eigenschappen van stoffen die kunnen worden waargenomen of gemeten zonder hun chemische identiteit te veranderen?  Waarom J -waarde voor wederzijds gekoppelde waterstofatomen berekend uit de NMR -print komt vaak niet overeen?
Waarom J -waarde voor wederzijds gekoppelde waterstofatomen berekend uit de NMR -print komt vaak niet overeen?
 Wetenschap-wat is een andere term voor staten?
Wetenschap-wat is een andere term voor staten?  Nieuwe kaart laat zien hoe de klimaatverandering uw gemeenschap en haar kwetsbaarheid voor weersomstandigheden beïnvloedt
Nieuwe kaart laat zien hoe de klimaatverandering uw gemeenschap en haar kwetsbaarheid voor weersomstandigheden beïnvloedt  Hoe beschrijven wetenschappelijke wetten de natuur?
Hoe beschrijven wetenschappelijke wetten de natuur?  Afdelingen van het plantenrijk
Afdelingen van het plantenrijk  Verwacht wordt dat de klimaatverandering het gevaar van natuurbranden zal vergroten
Verwacht wordt dat de klimaatverandering het gevaar van natuurbranden zal vergroten
Hoofdlijnen
- Hoe veehouderijsystemen fungeren als reservoir voor antimicrobieel resistente bacteriën
- Bronnen van het lactase-enzym
- Waarom is een pH-waarde van 7,8 het beste om de enzymactiviteit te beïnvloeden?
- Wat is het minst gebruikelijke bioom?
- Wat werken de verschillende soorten bloedcellen samen om immuunrespons te produceren?
- Wetenschappers hebben oude, bedreigde prikvissen gevonden in Queensland, 1400 km ten noorden van het eerder bekende verspreidingsgebied
- Hoe te lezen Proteïne elektroforese
- Is een ontleder een organisme dat zijn energie vandaan haalt?
- Hoe reproduceren virussen?
- Een zeer gevoelig SERS-substraat voor gasdetectie

- De meeste eiwitinformatie ooit vastgelegd in een enkele cel dankzij nieuwe nanoPOTS-technologie

- Nieuwe stappen voor de dynamiek van polymeerketens
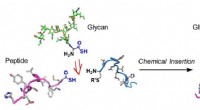
- Een winnende combinatie voor glycoproteïnesynthese
- Nieuw apparaat biedt snellere manier om antibioticaresistente bacteriën te detecteren

 Uber zelfrijdende crash roept veiligheid op, regels in twijfel
Uber zelfrijdende crash roept veiligheid op, regels in twijfel Een wiskundetabel online maken
Een wiskundetabel online maken Wat biedt de warmte in zonlicht?
Wat biedt de warmte in zonlicht?  Nieuwe fotokatalysator kan efficiëntere waterstofproductie mogelijk maken
Nieuwe fotokatalysator kan efficiëntere waterstofproductie mogelijk maken Wetenschappers ontwikkelen een nieuwe aanpak om weefselspecifieke eiwit-eiwitinteracties te ondervragen
Wetenschappers ontwikkelen een nieuwe aanpak om weefselspecifieke eiwit-eiwitinteracties te ondervragen  Bevroren bellen viraal video-geïnspireerd onderzoek nu gepubliceerd
Bevroren bellen viraal video-geïnspireerd onderzoek nu gepubliceerd Wat is de term voor organische materie die opgeslagen energie bevat?
Wat is de term voor organische materie die opgeslagen energie bevat?  Waarom hebben calciumoxide en natriumchloride verschillende smeltpunten?
Waarom hebben calciumoxide en natriumchloride verschillende smeltpunten?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

