
Wetenschap
Waarom lost methaan op in ethanol?
Dit is waarom:
* "zoals oplost zoals": Het principe "Like Lost Like" regelt oplosbaarheid. Dit betekent dat stoffen met vergelijkbare polariteit de neiging hebben om in elkaar op te lossen. Polaire moleculen worden aangetrokken door andere polaire moleculen door dipool-dipoolinteracties, terwijl niet-polaire moleculen worden aangetrokken tot andere niet-polaire moleculen door dispersiekrachten in Londen.
* Polariteitsverschillen: De tetrahedrale vorm van methaan en de gelijke delen van elektronen tussen koolstof en waterstofatomen maken het een niet -polair molecuul. Ethanol daarentegen heeft een polaire hydroxylgroep (OH) die een aanzienlijk dipoolmoment creëert.
* Zwakke interacties: De interactie tussen methaan en ethanol is zwak, voornamelijk gebaseerd op Londense dispersietroepen. Deze krachten zijn niet sterk genoeg om de sterkere dipool-dipoolinteracties tussen ethanolmoleculen te overwinnen.
Daarom lost methaan niet gemakkelijk op in ethanol.
Belangrijke opmerking: Hoewel de oplosbaarheid van methaan in ethanol erg laag is, is het niet helemaal nul. Er kan enige minimale oplossing zijn vanwege de zeer zwakke dispersiekrachten in Londen, maar het is te verwaarlozen in vergelijking met de oplosbaarheid van andere niet -polaire moleculen in ethanol.
 Wat een opwarmende wereld betekent voor dodelijke tornado's en het soort stormen dat ze voortbrengt
Wat een opwarmende wereld betekent voor dodelijke tornado's en het soort stormen dat ze voortbrengt  Continentale pirouettes:Supervulkaan gevoed vanuit de aardmantel zorgde ervoor dat aardplaten roteerden
Continentale pirouettes:Supervulkaan gevoed vanuit de aardmantel zorgde ervoor dat aardplaten roteerden Studie geeft nieuw inzicht in hoe klimaatverandering de barrière-eilanden van Virginia transformeert
Studie geeft nieuw inzicht in hoe klimaatverandering de barrière-eilanden van Virginia transformeert  Vanuatu is van plan om het hele vulkanische eiland permanent te evacueren
Vanuatu is van plan om het hele vulkanische eiland permanent te evacueren Wat is een regenwoud zo belangrijk?
Wat is een regenwoud zo belangrijk?
Hoofdlijnen
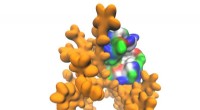
- Behandeling van antibioticaresistente infecties met peptiden geïnspireerd op menselijk speeksel
- Onderzoekers laten zien wat een nieuwe, geordende assemblage van afwisselende peptiden drijft
- Deze zomer naar het strand? Hier zijn enkele van onze beste dieren om op te letten
- Onderzoek bij wormen biedt een model om te bestuderen hoe het microbioom de ziekte bij mensen beïnvloedt
- Werkmodel over voedsellandbouw voor klasse 11e biologie?
- Hoe te voorkomen dat muggenvissen zich verspreiden in waterecosystemen
- Wat reduceert bacteriën tot een veilig niveau?
- Kunnen organismen die er anders uitzien dezelfde soort zijn?
- Hoe verschillen oogenese en spermantogenese?
- Wetenschappers maken multifunctionele eiwit-polymeerfilms
- Een nieuwe gouden standaardverbinding voor het opwekken van elektriciteit uit warmte

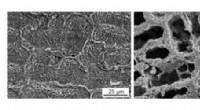
- Onderzoekers versterken zwakste schakel in productie van sterke materialen
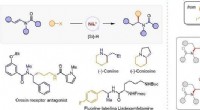
- Chirale amines gesynthetiseerd door nikkel-gekatalyseerde asymmetrische reductieve hydroalkylering
- MOF-cokatalysator maakt selectiviteit van vertakte aldehyden tot 90% mogelijk

 De beroemde zeshoek van Saturnus torent misschien boven de wolken uit
De beroemde zeshoek van Saturnus torent misschien boven de wolken uit Hoe eco-angst werkt
Hoe eco-angst werkt  Laat de zon binnen:zelfreinigend membraan onder behandeling met zichtbaar licht
Laat de zon binnen:zelfreinigend membraan onder behandeling met zichtbaar licht Hersenweefsel wekenlang in leven gehouden op een kunstmatig membraan
Hersenweefsel wekenlang in leven gehouden op een kunstmatig membraan Wetenschapsprojecten Over welk type chocolade de snelste smelt
Wetenschapsprojecten Over welk type chocolade de snelste smelt  Wat wordt materialen met lage weerstand genoemd?
Wat wordt materialen met lage weerstand genoemd?  Een scheikundige heeft één oplossing die voor 80 procent uit zuur bestaat en nog eens uit 30 procent. Hoeveel van de eerste oplossing is nodig om 400 L 62 zuur te maken?
Een scheikundige heeft één oplossing die voor 80 procent uit zuur bestaat en nog eens uit 30 procent. Hoeveel van de eerste oplossing is nodig om 400 L 62 zuur te maken?  Explosie van een supernova vertrekt?
Explosie van een supernova vertrekt?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

