
Wetenschap
Hersenweefsel wekenlang in leven gehouden op een kunstmatig membraan
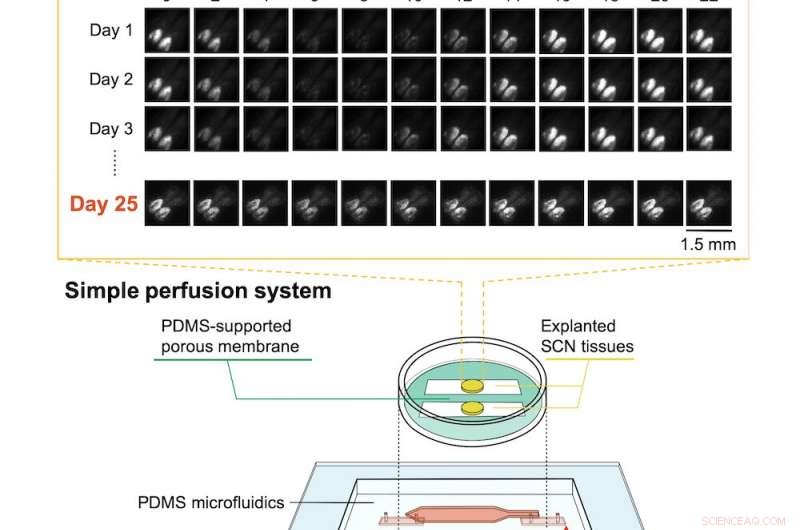
Bodem:de microdevice-opstelling met geëxplanteerd suprachiasmatisch kern (SCN) weefsel. Boven:ritmische circadiane activiteit was na 25 dagen nog steeds duidelijk, zoals aangegeven door bioluminescentie beeldvorming. Krediet:RIKEN
Onderzoekers van het RIKEN Center for Biosystems Dynamics Research in Japan hebben een nieuw systeem ontwikkeld om weefsel levensvatbaar te houden voor langdurig onderzoek nadat het van een dier naar een kweekmedium is overgebracht. Het nieuwe systeem maakt gebruik van een microfluïdisch apparaat dat kan voorkomen dat weefsel uitdroogt en verdrinkt in vloeistof. Een proof-of-concept-experiment toonde aan dat weefsel geëxplanteerd uit de muizenhersenen levensvatbaar bleef na bijna een maand in kweek, veel langer dan mogelijk is met andere microfluïdische kweekmethoden, en ook veel eenvoudiger.
Experimenteren met weefsels in kweek kan het ontdekken van medicijnen vergemakkelijken omdat onderzoekers het weefsel systematisch kunnen manipuleren en verschillende medicijnen of medicijncombinaties kunnen testen. Echter, bij het bestuderen van een heel systeem waarin veel cellen met elkaar moeten interageren, het is moeilijk gebleken om het weefsel langer dan een paar dagen "levend" te houden. Weefsel droogt snel uit en sterft af, tenzij het in een nat kweekmedium met geschikte voedingsstoffen wordt geplaatst. Anderzijds, het onderdompelen van complex weefsel in vloeistof kan het weefsel beschadigen omdat het de normale overdracht van gassen daartussen niet mogelijk maakt.
Om dit probleem op te lossen, de RIKEN-wetenschappers ontwikkelden een microfluïdisch apparaat met behulp van polydimethylsiloxaan (PDMS), het materiaal dat vaak wordt gebruikt als ontschuimer in vrij verkrijgbare medicijnen. Het apparaat heeft een semi-permeabel kanaal omgeven door een kunstmatig membraan en stevige PDMS-wanden. In plaats van constant ondergedompeld te worden in vloeistof, het weefsel profiteerde van het laten circuleren van het kweekmedium in het microkanaal en door het permeabele membraan, waardoor een goede gasuitwisseling mogelijk was. Dit klinkt simpel, maar het vinden van de optimale instellingen bleek een uitdaging. Zoals eerste auteur Nobutoshi Ota opmerkt, "Het regelen van de mediumstroom was moeilijk omdat het microkanaal dat zich vormde tussen de PDMS-wanden en het poreuze membraan ongebruikelijk was. we hadden succes na trial-and-error-modificaties aan het poreuze membraan en aanpassingen van de inlaat-/uitlaatstroomsnelheden."
Het team testte het apparaat met weefsel van de suprachiasmatische muiskern, een complex deel van de hersenen dat de circadiane ritmes regelt. De muizen zelf waren knock-in muizen waarbij de activiteit van het circadiane ritme in de hersenen was gekoppeld aan de productie van een sterk fluorescerend eiwit. Door het niveau van bioluminescentie afkomstig van het hersenweefsel te meten, ze konden zien dat weefsel dat door hun systeem in leven werd gehouden, meer dan 25 dagen actief en functioneel bleef met een mooie circadiane activiteit. In tegenstelling tot, neurale activiteit in weefsel dat in een conventionele kweek werd gehouden, nam na slechts 10 uur met 6% af.
Deze nieuwe methode heeft verschillende voordelen. Op korte termijn, het zal nuttig zijn bij het observeren van biologische ontwikkeling en het testen hoe weefsels op medicijnen reageren. Ook de voordelen op lange termijn zijn duidelijk. "Deze methode kan worden gebruikt voor meer dan geëxplanteerde weefsels van dieren, " zegt Ota. "Het zal ook het onderzoek naar organogenese verbeteren door middel van langdurige kweek en observatie die nodig is voor het kweken van weefsel en organen."
Inderdaad, het team plant momenteel langetermijnexperimenten met behulp van hun systeem om de vorming van bloedvaten en de bewegingen van cellen tijdens de vorming van organoïden te observeren.
Deze studie is gepubliceerd in het tijdschrift Analytische wetenschappen .
 Hoe maak je een Island School Project
Hoe maak je een Island School Project  How to Make Hummingbird Food for Feeders
How to Make Hummingbird Food for Feeders Een oplossing voor het opruimen van PFAS, een van 's werelds meest hardnekkige verontreinigende stoffen
Een oplossing voor het opruimen van PFAS, een van 's werelds meest hardnekkige verontreinigende stoffen Oor op de grond, luisteren naar nucleaire ontploffing
Oor op de grond, luisteren naar nucleaire ontploffing Evacuaties breiden zich uit in Oregon terwijl vuur zich grillig verspreidt
Evacuaties breiden zich uit in Oregon terwijl vuur zich grillig verspreidt
Hoofdlijnen
- Onderzoeker ontdekt dat wanneer sperma concurreert, eieren hebben een keuze
- DropSynth, een eenpotsbenadering van gensynthese
- Caribische bidsprinkhanen hebben een oude Afrikaanse oorsprong
- De functies van de linker temporale kwab
- Hoe voeden bacteriën?
- Dit is waarom je duurzame tonijn ook onhoudbaar is
- Hoe wordt een zuivere cultuur direct voorbereid?
- Orgelsystemen betrokken bij homeostase
- Zeeslakken weten hoe ze hun huisvestingskosten moeten begroten
- Polymeerprofessor ontwikkelt veiliger onderdeel voor lithiumbatterijen

- Kan aluminium worden verwarmd en gebogen?

- Dubbel gedoteerde koolstofmicrosferen met sterk stikstof en zwavel voor supercondensatoren
- Hoe de concentratie van ionen in een 0,010 waterige oplossing van zwavelzuur
- SpaceMat:Graphenes antwoord op de lancering van rubber voor recycling van banden op de markt

 Oude gesneden slang gevonden in Finland
Oude gesneden slang gevonden in Finland Team rapporteert schaalbare fabricage van zelf-uitgelijnde grafeentransistors, circuits
Team rapporteert schaalbare fabricage van zelf-uitgelijnde grafeentransistors, circuits 54 miljoen jaar oude fossiele vliegen geven nieuw inzicht in de evolutie van het gezichtsvermogen
54 miljoen jaar oude fossiele vliegen geven nieuw inzicht in de evolutie van het gezichtsvermogen Optimale kwantumberekening gekoppeld aan zwaartekracht
Optimale kwantumberekening gekoppeld aan zwaartekracht Waarom voertuigen op batterijen beter presteren dan waterstof
Waarom voertuigen op batterijen beter presteren dan waterstof Frankrijk verhoogt investering in batterijcellen voor elektrische auto's
Frankrijk verhoogt investering in batterijcellen voor elektrische auto's Radartracking onthult hoe bijen een route tussen bloemen ontwikkelen
Radartracking onthult hoe bijen een route tussen bloemen ontwikkelen Wat te doen als Facebook zegt dat je gegevens zijn gebruikt door Cambridge Analytica
Wat te doen als Facebook zegt dat je gegevens zijn gebruikt door Cambridge Analytica
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway | Italian |

-
Wetenschap © https://nl.scienceaq.com

