
Wetenschap
Wat zorgt ervoor dat chemische binding tijdens een reactie breken?
1. Energie -invoer:
* warmte: Het aanbieden van warmte -energie verhoogt de kinetische energie van de moleculen, waardoor ze krachtiger trillen. Deze verhoogde trillingen kan de bindingen verzwakken, waardoor ze gevoeliger zijn voor breken.
* licht: Bepaalde lichtlengten van licht kunnen voldoende energie hebben om bindingen direct te verbreken, zoals te zien in fotochemische reacties.
* elektriciteit: Het toepassen van een elektrische stroom kan de nodige energie bieden om bindingen te verbreken, zoals bij elektrolyse.
2. Botsing met andere moleculen:
* reactanten: Wanneer reactanten botsen met voldoende energie en een juiste oriëntatie, kunnen hun bindingen breken, waardoor er nieuwe bindingen kunnen worden gevormd met andere reactanten. Dit is de basis van veel chemische reacties.
* katalysator: Katalysatoren verlagen de activeringsenergie die nodig is om een reactie te laten optreden, waardoor de kans op bindingsbreuk en vorming bij lagere temperaturen vergroot.
3. Elektrostatische interacties:
* polariteit: Moleculen met sterke dipolen kunnen de elektronenverdeling in andere moleculen beïnvloeden, bestaande bindingen verzwakken en nieuwe bindingsvorming vergemakkelijken.
* ionisatie: Het creëren van ionen (geladen soorten) kan bestaande elektrostatische attracties binnen een molecuul verstoren, wat leidt tot binding.
4. Bindingssterkte:
* Zwakke bindingen: Bindingen zoals waterstofbruggen en van der Waals -krachten zijn relatief zwak en kunnen gemakkelijk breken met kleine energie -inputs.
* Sterke bindingen: Covalente bindingen, met name die met sterk elektronegatieve atomen, zijn over het algemeen sterk en vereisen aanzienlijke energie -input om te breken.
5. Entropische overwegingen:
* Gunstige producten: Als de producten van een reactie stabieler zijn (lagere energie) dan de reactanten, zal de reactie doorgaan, zelfs als er enige energie nodig is om de bindingen in de reactanten te verbreken.
Samenvattend is het breken van chemische bindingen tijdens een reactie een complex samenspel van energie -input, moleculaire botsingen, elektrostatische interacties, bindingssterkte en entropische overwegingen. Het specifieke mechanisme voor het breken van bindingen zal variëren, afhankelijk van de specifieke reactie en de omstandigheden ervan.
 Wat zijn de elementen aanwezig in C17H21N04?
Wat zijn de elementen aanwezig in C17H21N04?  Glucagon-receptorstructuur biedt nieuwe mogelijkheden voor het ontdekken van geneesmiddelen voor type 2 diabetes
Glucagon-receptorstructuur biedt nieuwe mogelijkheden voor het ontdekken van geneesmiddelen voor type 2 diabetes Wat is het oxidatiegetal van uranium?
Wat is het oxidatiegetal van uranium?  Interdisciplinair team ontwerpt gasstroomcel om katalytisch gedrag te analyseren
Interdisciplinair team ontwerpt gasstroomcel om katalytisch gedrag te analyseren Wat is een asymmetrische synthese?
Wat is een asymmetrische synthese?
 Wetenschappers voorspellen hoeveel plastic dieren kunnen eten
Wetenschappers voorspellen hoeveel plastic dieren kunnen eten Tyfoons en mariene eutrofiëring zijn waarschijnlijk de ontbrekende bron van organische stikstof in ecosystemen
Tyfoons en mariene eutrofiëring zijn waarschijnlijk de ontbrekende bron van organische stikstof in ecosystemen Klimaatcrisis waardoor gezinnen boeren mijden voor gearrangeerde huwelijken
Klimaatcrisis waardoor gezinnen boeren mijden voor gearrangeerde huwelijken Vraag en antwoord:een blik op vragen over de huidige bosbranden in de VS
Vraag en antwoord:een blik op vragen over de huidige bosbranden in de VS Trump heft mandaat voor koolstofafvang voor nieuwe kolencentrales op bron zegt
Trump heft mandaat voor koolstofafvang voor nieuwe kolencentrales op bron zegt
Hoofdlijnen
- Wat zijn de structuren en functies van Nucleolus?
- De Rode Zee heeft mogelijk een kraamkamer voor oceanische mantaroggen
- Welk enzym gebruiken wetenschappers om genen uit strengen te snijden als DNA?
- Vluchtpatronen onthullen hoe muggen gastheren vinden om dodelijke ziekten over te brengen
- Welk type informatie wordt gepresenteerd door een wetenschapper die reden heeft die een bepaalde manier presenteert?
- Wat is de definitie van lysosoom?
- Wat zijn de producten van fotosynthese. Waar gaan ze naartoe?
- Wat is geïnduceerd paaigans?
- Welk deel van de celcyclus is eigenlijk gewijd aan deling?
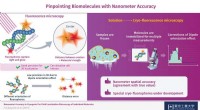
- Biomoleculen lokaliseren met nanometernauwkeurigheid
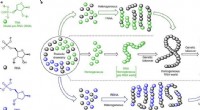
- Onderzoekers suggereren dat RNA en DNA hun oorsprong hebben gevonden in RNA-DNA-chimeren
- Plantaardig afval spinnen tot koolstofvezel voor auto's, vliegtuigen
- Kristallisatie opgehelderd, onderzoekers rapporteren

- Onderzoeksconsortium produceert 3D-kaart met hoge resolutie van GLP-1R
 Wat is een cel met paren chromosomen genoemd en geen chromosomen?
Wat is een cel met paren chromosomen genoemd en geen chromosomen?  Nieuwe technologie zou kunnen leiden tot snelle, minimaal invasieve kankerdiagnoses
Nieuwe technologie zou kunnen leiden tot snelle, minimaal invasieve kankerdiagnoses  Lithiumionen stromen door vast materiaal
Lithiumionen stromen door vast materiaal Millihertz quasi-periodieke oscillaties gedetecteerd in de röntgenbinaire EXO 0748−676
Millihertz quasi-periodieke oscillaties gedetecteerd in de röntgenbinaire EXO 0748−676 Welk gas moeten mensen inademen om te kunnen leven?
Welk gas moeten mensen inademen om te kunnen leven?  Hoe snel zou de snelheid van het geluid zijn als je in de ruimte kon horen?
Hoe snel zou de snelheid van het geluid zijn als je in de ruimte kon horen?  Is een goed gekookte steak chemische of fysieke verandering?
Is een goed gekookte steak chemische of fysieke verandering?  Het verschil tussen Glacier Ice & Sea Pack Ice
Het verschil tussen Glacier Ice & Sea Pack Ice
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

