
Wetenschap
Hoe voltooit het koolstofatoom zijn octet?
1. Vorm covalente bindingen: Koolstof kan zijn vier valentie -elektronen delen met andere atomen om covalente bindingen te vormen. Hierdoor kan elk koolstofatoom elektronen delen en ze effectief "tellen" naar zijn octet.
* Voorbeeld: In methaan (CH4) deelt koolstof één elektron met elk van de vier waterstofatomen, waardoor het octet wordt voltooid. Elk waterstofatoom krijgt ook een elektron om zijn buitenste schaal (duet) te vullen.
2. Vorm ionische bindingen (zelden): In extreem zeldzame gevallen kan koolstof elektronen verliezen of verkrijgen om ionische bindingen te vormen. Dit komt echter veel minder vaak voor dan het vormen van covalente bindingen als gevolg van de relatief hoge ionisatie -energie van koolstof.
* Voorbeeld: In sommige exotische verbindingen kan koolstof bestaan als een carbide-ion (C4-) waar het vier elektronen heeft opgedaan om zijn octet te voltooien. Deze verbindingen zijn echter zeer reactief en onstabiel.
Samenvattend: Koolstof bereikt typisch een stabiel octet door covalente bindingen te vormen Met andere atomen, het delen van elektronen om zijn buitenste schaal te voltooien.
 Waarom worden NaCl en MGCL2 beide als zuur getoond met verschillende indicatoren, maar ze eigenlijk neutraal?
Waarom worden NaCl en MGCL2 beide als zuur getoond met verschillende indicatoren, maar ze eigenlijk neutraal?  Wat is het nut van kookbuis?
Wat is het nut van kookbuis?  Een uitgebreide metabole kaart voor de productie van biogebaseerde chemicaliën
Een uitgebreide metabole kaart voor de productie van biogebaseerde chemicaliën Wat is de uitgebalanceerde symboolvergelijking voor kalium en zuurstof?
Wat is de uitgebalanceerde symboolvergelijking voor kalium en zuurstof?  Een natuurlijk voorkomende bodembacterie kan een oplossing bieden voor eeuwigdurende chemicaliën
Een natuurlijk voorkomende bodembacterie kan een oplossing bieden voor eeuwigdurende chemicaliën
Hoofdlijnen
- Het onzichtbare zien:hoe vlinders wetenschappers kunnen helpen kanker op te sporen
- Wat zijn de belangrijkste functies van eenvoudige koolhydraten in levende wezens?
- Wat zijn klaprozen?
- Waarom is de mitochondriën belangrijk in cellen?
- Het virus dat waterpokken veroorzaakt, bevat DNA. Het reproduceert in de cellen van levende organismen. is niet gemaakt en eet of ademt. Waarom wordt het niet als iets beschouwd?
- De volgorde van de slakvissen uit de Mariana Trench onthult aanwijzingen over hoe deze zich aanpaste om in zulk diep water te leven
- Hoe overleven parasieten?
- Wat is een tussenliggende sequentie van DNA die niet tot expressie wordt gebeld?
- Wat doet de mitocondion?
- Nieuw proces stimuleert lignine bio-olie als brandstof van de volgende generatie

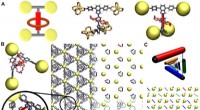
- Natuurkundigen decoderen de dynamische interactie tussen moleculaire machines in metaal-organische raamwerken
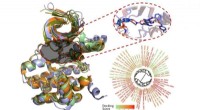
- Computermodellering van WNK-kinaseremmers kan nieuwe hulpmiddelen bieden voor het begrijpen van hypertensie
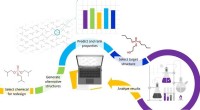
- Hoe ontwerp je veilige en duurzame chemicaliën
- Bewaar ambachtelijk bier op een koele plaats en consumeer het zo vers mogelijk

 Omtrek van de planeten in Miles
Omtrek van de planeten in Miles Deep-learning algoritmen gebruiken om kaarten van scheepssporen te maken
Deep-learning algoritmen gebruiken om kaarten van scheepssporen te maken Apples iPhone-verkopen dalen terwijl Chinas Huawei wint
Apples iPhone-verkopen dalen terwijl Chinas Huawei wint Delen van het periodiek systeem
Delen van het periodiek systeem  Op zoek naar de negende planeet
Op zoek naar de negende planeet Wetenschappers ontdekken precies hoe vleermuizen vliegen
Wetenschappers ontdekken precies hoe vleermuizen vliegen  Onderzoek suggereert dat klimaatverandering planten bovengronds meer treft dan onder de grond
Onderzoek suggereert dat klimaatverandering planten bovengronds meer treft dan onder de grond Afdeling uitleggen aan een derde grader
Afdeling uitleggen aan een derde grader
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

