
Wetenschap
Wat doet zwavelmonoxide?
Dit is waarom:
* de typische oxidatietoestanden van Sulphur: Zwavel vormt meestal verbindingen in oxidatietoestanden van +2, +4 of +6.
* Typische oxidatietoestand van Oxygen: Zuurstof heeft meestal een oxidatietoestand van -2.
* valentie -elektronen: Zwavel heeft zes valentie -elektronen en zuurstof heeft er zes. Om een stabiel octet te bereiken, zou zwavel twee elektronen moeten krijgen en zou zuurstof twee elektronen moeten krijgen.
* onstabiel molecuul: Een molecuul met één zwavel en één zuurstofatoom zou niet voldoen aan de octetregel voor beide elementen. Dit maakt een stabiel zwavelmonoxidemolecuul onmogelijk.
waar je misschien aan denkt:
* zwaveldioxide (SO2): Dit is een veel voorkomende en stabiele verbinding. Het is een kleurloos gas met een scherpe geur, vaak geproduceerd tijdens het verbranden van fossiele brandstoffen.
* zwaveltrioxide (SO3): Een andere stabiele verbinding, dit is een kleurloze vloeistof die zeer reactief is en een belangrijk ingrediënt bij de productie van zwavelzuur.
Als u verwijst naar een specifieke chemische reactie of proces, geef dan meer context en ik kan u helpen te begrijpen wat er zou kunnen gebeuren.
 Waarom isotopen van een element met minder neutronen hebben lagere dichtheden en smeltende kookpunten?
Waarom isotopen van een element met minder neutronen hebben lagere dichtheden en smeltende kookpunten?  Wanneer een atoom ioniseert, doet het wat?
Wanneer een atoom ioniseert, doet het wat?  Dat bevriest sneller uit zout watersuiker en tik waarom?
Dat bevriest sneller uit zout watersuiker en tik waarom?  Fouten in titratie-experimenten
Fouten in titratie-experimenten  Als een materiaalsamenstelling varieert van regio tot deze kan worden geclassificeerd als?
Als een materiaalsamenstelling varieert van regio tot deze kan worden geclassificeerd als?
 Schattingen van emissies van aardgasgestookte centrales veel te laag, studie vondsten
Schattingen van emissies van aardgasgestookte centrales veel te laag, studie vondsten Giftige chemicaliën bellen:mobiele telefoons als bron van vlamvertragers
Giftige chemicaliën bellen:mobiele telefoons als bron van vlamvertragers Hoe kolibries de wind bestrijden:een robotapparaat helpt bij het analyseren van zwevende vogels
Hoe kolibries de wind bestrijden:een robotapparaat helpt bij het analyseren van zwevende vogels  Wat is vijvervegetatie?
Wat is vijvervegetatie?  Wat is het Coldist Biome op aarde?
Wat is het Coldist Biome op aarde?
Hoofdlijnen
- Wat voor soort gewervelde dieren leven altijd een dubbelleven gedeeltelijk in water en op het land?
- Wat zou de korte conclusie zijn voor het biologieproject op olievlekken?
- Wat is de massa van een gemiddelde cel?
- Actine-onderzoek laat zien hoe vlindervleugels hun levendige kleuren krijgen
- Het erfelijke materiaal van levende wezens is?
- Wat kan worden toegevoegd om de bacteriegroei op schimmelgebaseerde media te onderdrukken?
- Hoe veranderingen in de omgeving de vormen van RNA in levende cellen beïnvloeden
- Welke structuren zorgen voor celbeweging?
- Wat zijn de opslagkamers binnen de cel?
- Wetenschappers ontwikkelen groenere, efficiëntere methode om antibiotica van de volgende generatie te produceren
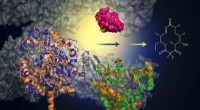
- Doorbraak in snelle, massale screening op het ebolavirus

- Osteoblastisch lysosoom speelt een centrale rol bij mineralisatie
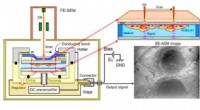
- UNESCO viert 150 jaar scheikunde periodiek systeem

- Een Rubiks microfluïdische kubus

 Een door aardappelen aangedreven lamp maken
Een door aardappelen aangedreven lamp maken Wetenschappelijke vooruitgang kan leiden tot het uitsterven van de mens
Wetenschappelijke vooruitgang kan leiden tot het uitsterven van de mens Zal 24VAC compatibel zijn met een 24 volt voeding?
Zal 24VAC compatibel zijn met een 24 volt voeding?  Hoe Basic Pre-Algebra-vergelijkingen te verklaren
Hoe Basic Pre-Algebra-vergelijkingen te verklaren Hoe sociale netwerksites vrouwen kunnen discrimineren
Hoe sociale netwerksites vrouwen kunnen discrimineren  Hoe vorm je koolstofdioxide?
Hoe vorm je koolstofdioxide?  Midden-infraroodbeelden van de Subaru-telescoop verlengen de ontdekkingen van Juno-ruimtevaartuigen
Midden-infraroodbeelden van de Subaru-telescoop verlengen de ontdekkingen van Juno-ruimtevaartuigen Wat voor soort rotsen bestonden tijdens de tertiaire periode?
Wat voor soort rotsen bestonden tijdens de tertiaire periode?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

