
Wetenschap
Wat is er ongebruikelijk aan de isotopische samenstelling van bromine?
Dit is waarom dit ongebruikelijk is:
* De meeste elementen hebben een dominante isotoop: Meestal is een isotoop van een element aanzienlijk overvloediger dan de andere. Koolstof heeft bijvoorbeeld een dominante isotoop, koolstof-12, die 98,9% van alle koolstof uitmaken.
* Bromine heeft een bijna perfecte 50/50 split: Bromine-79 en Bromine-81 zijn te vinden in bijna exact een 1:1-verhouding. Dit maakt Bromine een beetje een uitbijter in termen van isotopische overvloed.
Deze bijna gelijkwaardige overvloed van de twee broomisotopen heeft een paar implicaties:
* Atomische massa is niet een heel getal: De atoommassa van broom is 79.904, wat het gemiddelde van zijn twee isotopen weerspiegelt. Dit is niet een heel getal, in tegenstelling tot veel andere elementen.
* Analytische toepassingen: De bijna gelijkwaardige overvloed maakt het gemakkelijker om broom te analyseren met behulp van technieken zoals massaspectrometrie.
Hoewel de reden voor deze bijna perfecte 50/50 splitsing niet volledig wordt begrepen, wordt aangenomen dat het verband houdt met de nucleaire eigenschappen van broom en zijn positie op het periodiek systeem.
 De nucleolus functioneert bij de productie van?
De nucleolus functioneert bij de productie van?  De verschillen tussen zuurstof en zuurstof
De verschillen tussen zuurstof en zuurstof AI-algoritme identificeert nieuwe verbinding die mogelijk nuttig is voor fotonische apparaten, biologisch geïnspireerde computers
AI-algoritme identificeert nieuwe verbinding die mogelijk nuttig is voor fotonische apparaten, biologisch geïnspireerde computers Welk bewijs geeft aan dat er een chemische verandering plaatsvond toen het ijzer en de zwavel gecombineerd werden om sulfide te vormen?
Welk bewijs geeft aan dat er een chemische verandering plaatsvond toen het ijzer en de zwavel gecombineerd werden om sulfide te vormen?  Kun je 2 eigenschappen van een vloeistof vermelden?
Kun je 2 eigenschappen van een vloeistof vermelden?
Hoofdlijnen
- Hoe informatie buiten de genetische sequentie wordt gecodeerd in plantensperma
- Wat is een impact van organismen?
- Waarom groeit schimmels op fruit en brood?
- Waar kwam de hypothese vandaan?
- Worden biologie en chemie beschouwd als geavanceerde wetenschappen?
- Landschaps- en klimaatfactoren kunnen de prevalentie van de ziekte van Lyme voorspellen
- Wat is het belang van wormen?
- Wat is de op een na hoogste taxonomische classificatie tussen koninkrijk en klasse?
- Wetenschappers vinden een manier om de negatieve impact van wolluizen op wijngaarden te voorkomen
- Licht op waarom plastic geel wordt
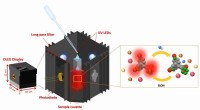
- Nieuw apparaat vereenvoudigt meting van fluorideverontreiniging in water
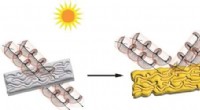
- Spinzijde kan worden gebruikt als robotspier

- Onderzoekers ontwikkelen computermodel om te voorspellen of een bestrijdingsmiddel schadelijk is voor bijen

- Voering van MOF-zakken om schadelijke gassen te detecteren

 Hoe beïnvloedt de hoeveelheid gassen in de atmosfeer de atmosfeer van warmte -energie?
Hoe beïnvloedt de hoeveelheid gassen in de atmosfeer de atmosfeer van warmte -energie?  Wanneer de zwaartekracht van zon en maan elkaar gedeeltelijk uit de aarde cancle, wat?
Wanneer de zwaartekracht van zon en maan elkaar gedeeltelijk uit de aarde cancle, wat?  Extreme hitte heeft invloed op de aandelenwaarde van bedrijven, studie vondsten
Extreme hitte heeft invloed op de aandelenwaarde van bedrijven, studie vondsten Welk type straling interageert met de ozon in de stratosfeer?
Welk type straling interageert met de ozon in de stratosfeer?  Oceaanstromingen dreigen de Antarctische ijsplaten te laten instorten, zo blijkt uit onderzoek
Oceaanstromingen dreigen de Antarctische ijsplaten te laten instorten, zo blijkt uit onderzoek  Wat gebeurt er met de dichtheid als deze opwarmt?
Wat gebeurt er met de dichtheid als deze opwarmt?  Hoe de afstand van een stad te vinden van de evenaar
Hoe de afstand van een stad te vinden van de evenaar Het universum begrijpen door middel van neutrino's
Het universum begrijpen door middel van neutrino's
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

