
Wetenschap
Waarom kan een natriumionenbinding met chloorionen?
* natrium (na) Heeft één elektron in zijn buitenste schaal. Het verliest gemakkelijk dit elektron om een stabiele elektronenconfiguratie te bereiken, zoals de Noble Gas Neon (NE). Wanneer het dit elektron verliest, wordt het een positief geladen ion, Na+.
* chloor (Cl) heeft zeven elektronen in zijn buitenste schaal. Het krijgt gemakkelijk één elektron om een stabiele elektronenconfiguratie te bereiken, zoals de Noble Gas Argon (AR). Wanneer het een elektron wint, wordt het een negatief geladen ion, Cl-.
Elektrostatische aantrekkingskracht: Tegengestelde kosten trekken aan. Het positief geladen natriumion (Na+) en het negatief geladen chloride-ion (Cl-) worden sterk tot elkaar aangetrokken vanwege deze elektrostatische kracht. Deze aantrekkingskracht is wat de ionische binding tussen hen vormt, wat resulteert in de vorming van natriumchloride (NaCl), ook bekend als tafelzout.
Samenvattend: De ionische binding tussen natrium en chloor wordt aangedreven door de wens van elk atoom om een stabiele elektronenconfiguratie te bereiken, wat leidt tot de vorming van tegengesteld geladen ionen die elkaar sterk aantrekken.
 Hoe het aanpakken van invasieve soorten op het land tot 'verbluffende' verbeteringen op zee kan leiden
Hoe het aanpakken van invasieve soorten op het land tot 'verbluffende' verbeteringen op zee kan leiden  Wat is de mooiste bug op aarde?
Wat is de mooiste bug op aarde?  Video:Hoogvliegend, oogverblindende drones verzamelen gegevens van stormen
Video:Hoogvliegend, oogverblindende drones verzamelen gegevens van stormen NASA-NOAA-satelliet vangt tropische cycloon Blake en branden in West-Australië
NASA-NOAA-satelliet vangt tropische cycloon Blake en branden in West-Australië Mercurius van het noordelijk halfrond komt terecht in Australië
Mercurius van het noordelijk halfrond komt terecht in Australië
Hoofdlijnen
- Is het gegarandeerd dat zodra mRNA tot expressie wordt gebracht, het gecodeerde genproduct ook tot expressie wordt gebracht?
- De transformatie van het oceaanbeheer is aan de gang, zo blijkt uit onderzoek
- Wat is het verschil tussen gametogenese bij vrouwelijke zoogdieren en mannelijke zoogdieren?
- Wat is de classificatie van een Colorado -kever?
- Leg uit waarom variaties nodig zijn om de natuurlijke selectie op te treden?
- Wat zijn eigenschappen die herkenbaar zijn genoemd?
- Wie stelt wetenschappelijke vragen?
- Wat zijn de onderdelen van de celcyclus?
- De opwarming van de aarde kan de leefgebieden van muggen een impuls geven, zo blijkt uit onderzoek
- Kleine oplichtende streepjescodes identificeren moleculen door hun fonkeling

- Afstembare omgekeerde fotochromen in vaste toestand

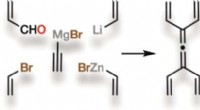
- Gespannen, symmetrisch, en nieuw:tetravinylalleen, een klein maar krachtig molecuul, is voor het eerst gesynthetiseerd
- Nieuwe katalysator voor elektrochemisch selectieve C=O-hydrogenering van kaneelaldehyde

- Wetenschappers ontwikkelen goedkope, vanadiumstroombatterijstapel met hoge vermogensdichtheid

 Is siliciumdioxide een mengsel of pure substantie?
Is siliciumdioxide een mengsel of pure substantie?  Een computerlens ontmaskert verborgen 3D-informatie uit één enkele 2D-microfoto
Een computerlens ontmaskert verborgen 3D-informatie uit één enkele 2D-microfoto  Een kolf wordt gewogen en heeft een massa van 50,0 gram en dan 2,0 natriummetaal toegevoegd aan het chloorgaas dat hierin wordt gepompt, maakt het volledig reageren met C?
Een kolf wordt gewogen en heeft een massa van 50,0 gram en dan 2,0 natriummetaal toegevoegd aan het chloorgaas dat hierin wordt gepompt, maakt het volledig reageren met C?  Wat is thermische opwarming?
Wat is thermische opwarming?  Welke moet gelden voor circumpolaire sterrenbeelden op de Zuidpool?
Welke moet gelden voor circumpolaire sterrenbeelden op de Zuidpool?  Wetenschappers onderzoeken eigenschappen van hybride systemen bestaande uit koolstofnanostructuren en een kleurstof
Wetenschappers onderzoeken eigenschappen van hybride systemen bestaande uit koolstofnanostructuren en een kleurstof Scholen en fabrieken gesloten na aardbevingszwerm nabij Napels
Scholen en fabrieken gesloten na aardbevingszwerm nabij Napels  Hoe het verschil tussen een monarch en een onderkoning te onderscheiden Butterfly
Hoe het verschil tussen een monarch en een onderkoning te onderscheiden Butterfly
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

