
Wetenschap
Hoe beïnvloeden verschillende opgeloste stoffen het kookpunt?
1. Niet-vluchtige opgeloste stoffen:
* Effect: Verhoog kookpunt
* mechanisme: Deze opgeloste stoffen verdampen niet gemakkelijk en blijven in de vloeibare fase. Ze verminderen de dampdruk van het oplosmiddel, waardoor het moeilijker is voor de oplosmiddelmoleculen om in de gasfase te ontsnappen. Om het kookpunt te bereiken, moet de dampdruk gelijk zijn aan de atmosferische druk, dus een hogere temperatuur is vereist.
* Voorbeelden: Suiker, zout, de meeste ionische verbindingen
2. Vluchtige opgeloste stoffen:
* Effect: Complexer; Kan toenemen, afnemen of hetzelfde blijven, afhankelijk van de volatiliteit van de opgeloste stof.
* mechanisme: Vluchtige opgeloste stoffen kunnen samen met het oplosmiddel verdampen, wat de totale dampdruk beïnvloedt.
* Als de opgeloste stof minder vluchtig is dan het oplosmiddel: Het kookpunt zal toenemen omdat de opgeloste stof de dampdruk van het oplosmiddel verlaagt.
* Als de opgeloste stof vluchtiger is dan het oplosmiddel: Het kookpunt zal afnemen omdat de opgeloste stof de dampdruk van het mengsel verhoogt.
* Als de opgeloste stof en oplosmiddel een vergelijkbare volatiliteit hebben: Het kookpunt kan relatief hetzelfde blijven.
* Voorbeelden: Ethanol in water, aceton in hexaan
3. Elektrolyten:
* Effect: Verhoog het kookpunt aanzienlijk dan niet-elektrolyten met dezelfde concentratie.
* mechanisme: Elektrolyten dissociëren in ionen in oplossing, waardoor het aantal aanwezige deeltjes toeneemt. Dit leidt tot een grotere vermindering van de dampdruk en een hoger kookpunt in vergelijking met niet-elektrolyten met hetzelfde aantal moleculen.
* Voorbeelden: NaCl, CaCl2, K2SO4
Key Concepts:
* Colligatieve eigenschappen: Kookpunthoogte is een colligatieve eigenschap, wat betekent dat het afhangt van de concentratie van opgeloste deeltjes, niet op de specifieke identiteit.
* Van't Hoff -factor (i): Deze factor is verantwoordelijk voor het aantal deeltjes die een opgeloste stof produceert wanneer opgelost. Voor niet-elektrolyten, i =1. Voor elektrolyten is ik groter dan 1 (bijv. NaCl:i =2, CACL2:i =3).
formule voor kookpunthoogte:
Δtb =i * kb * m
Waar:
* Δtb =kookpunthoogte
* i =van't hoff -factor
* Kb =molaal kookpunthoogteconstante (specifiek voor het oplosmiddel)
* m =molaliteit (mol opgeloste stof per kilogram oplosmiddel)
Samenvattend:
* Niet-vluchtige opgeloste stoffen verhogen het kookpunt in het algemeen.
* Volatiele opgeloste stoffen kunnen toenemen, verminderen of weinig effect hebben op het kookpunt, afhankelijk van hun volatiliteit ten opzichte van het oplosmiddel.
* Elektrolyten verhogen het kookpunt aanzienlijk dan niet-elektrolyten vanwege hun dissociatie in ionen.
Het specifieke effect van een opgeloste stof op het kookpunt kan worden berekend met behulp van de kookpunthoogte -formule en het overwegen van de aard van de opgeloste stof en de concentratie ervan.
 Welk element vormt in combinatie met fluor waarschijnlijk een ionische verbinding?
Welk element vormt in combinatie met fluor waarschijnlijk een ionische verbinding?  Wat is de balans chemische vergelijking voor de productie van koolstoftetrachloride?
Wat is de balans chemische vergelijking voor de productie van koolstoftetrachloride?  Wat is de term voor een vaste vorm wanneer twee oplossingen worden gemengd?
Wat is de term voor een vaste vorm wanneer twee oplossingen worden gemengd?  Welke van de volgende isotopische verhoudingen worden gebruikt om absolute bepalingen tijdvormingsmaterialen te maken?
Welke van de volgende isotopische verhoudingen worden gebruikt om absolute bepalingen tijdvormingsmaterialen te maken?  Wat is een algemene vergelijking voor een endotherme dubbele vervangingsreactie?
Wat is een algemene vergelijking voor een endotherme dubbele vervangingsreactie?
Hoofdlijnen
- Hoe kolonies in de microbiologie te tellen
- Hoeveel delen is het menselijk lichaam verdeeld?
- Massa-extincties verwijderen soorten, maar geen ecologische variëteit
- Wat is een voorbeeld van symbiose in het graslandbioom?
- Nieuwe slangensoort verstopt zich in het volle zicht
- Studie belicht botanische vooroordelen
- Wanneer een organisme zoals gist leeft door fermentatie, zet het pyrodruivenzuur uit glycolsis om in een andere samengestelde alcohol. Waarom direct uitscheiden?
- Wat was het resultaat van het voeren van zeekoeien met 100 ton sla? Ambtenaren denken na over lessen
- Hoe vertel je een plantenweefsel uit een dierenweefsel?
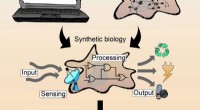
- Biologische signaalprocessen in intelligente materialen
- Lenen van de natuur om de kracht van de zon aan te boren

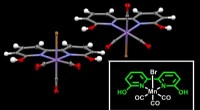
- Mangaan aanwerven om koolstofdioxide op te waarderen
- Nieuwe studie bevestigt de in 1953 voorspelde gegolfde eiwitstructuur

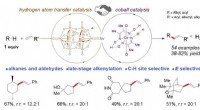
- Nieuwe methode voor functionalisering van koolstof-waterstofbindingen in een laat stadium
 Het lokeffect:hoe je wordt beïnvloed om te kiezen zonder het echt te weten
Het lokeffect:hoe je wordt beïnvloed om te kiezen zonder het echt te weten  Met behulp van renormalisatiegroepmethoden bestuderen we hoe de hersenen informatie verwerken
Met behulp van renormalisatiegroepmethoden bestuderen we hoe de hersenen informatie verwerken  Welke soorten rotsen het meest gemakkelijk en het minst gemakkelijk?
Welke soorten rotsen het meest gemakkelijk en het minst gemakkelijk?  Minstens 44 doden door plotselinge overstromingen in het noordoosten van de VS
Minstens 44 doden door plotselinge overstromingen in het noordoosten van de VS Wat zijn de oppervlakte- en ondergrondmethoden met welke steenkool vaak wordt gedolven?
Wat zijn de oppervlakte- en ondergrondmethoden met welke steenkool vaak wordt gedolven?  Astronomen onderzoeken extreme variabiliteit van de actieve galactische kern van Big Dipper
Astronomen onderzoeken extreme variabiliteit van de actieve galactische kern van Big Dipper Hoe wordt energie overgedragen met een papieren shredder?
Hoe wordt energie overgedragen met een papieren shredder?  Hoe is de snelheid van een planeet gerelateerd aan zijn afstand tot zon?
Hoe is de snelheid van een planeet gerelateerd aan zijn afstand tot zon?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

