
Wetenschap
Waarom natriumchloride elektriciteit in kristallijne vorm leiden?
* ionische binding: Natriumchloride is een ionische verbinding, wat betekent dat deze wordt gevormd door de elektrostatische aantrekkingskracht tussen positief geladen natriumionen (Na+) en negatief geladen chloride-ionen (Cl-). Deze ionen zijn gerangschikt in een rigide, kristallijn rooster.
* Vaste ionen: In de vaste toestand worden deze ionen in vaste posities binnen de kristalstructuur gehouden. Ze kunnen niet vrij bewegen, wat cruciaal is voor elektrische geleidbaarheid.
* Geen gratis ladingsdragers: Voor een stof om elektriciteit te leiden, heeft deze gratis ladingsdragers nodig die een elektrische stroom kunnen verplaatsen en dragen. In solide NaCl zijn er geen vrije elektronen of ionen om deze beweging te vergemakkelijken.
Hier is hoe NaCl elektriciteit geleidt:
* gesmolten toestand (vloeistof): Wanneer NaCl wordt gesmolten, breken de ionische bindingen en worden de ionen vrij om te bewegen. Deze mobiele ionen fungeren als ladingsdragers, waardoor de gesmolten NaCl elektriciteit kan leiden.
* waterige oplossing: Wanneer opgelost in water, dissocieert NaCl in zijn samenstellende ionen (Na+ en Cl-), die opnieuw vrij zijn om te bewegen, waardoor de oplossing een elektrische geleider is.
Samenvattend: Solid natriumchloride leidt geen elektriciteit omdat zijn ionen in het kristalrooster zijn gefixeerd. Alleen wanneer het zich in een gesmolten toestand bevindt of opgelost in water, zorgen de vrije ionen voor elektrische geleidbaarheid.
 Begeleiding ter plaatse voor de verreikende klimaatstrategie van L.A.
Begeleiding ter plaatse voor de verreikende klimaatstrategie van L.A. De aarde kan tegen 2024 tijdelijk de gevaarlijke opwarmingslimiet van 1,5 C overschrijden, belangrijk nieuw rapport zegt:
De aarde kan tegen 2024 tijdelijk de gevaarlijke opwarmingslimiet van 1,5 C overschrijden, belangrijk nieuw rapport zegt: Prentenboek geeft kinderen kracht, gezinnen om klimaatverandering aan te pakken
Prentenboek geeft kinderen kracht, gezinnen om klimaatverandering aan te pakken Wat zorgde voor de recordhittegolf in Perth en waarom het een voorproefje is van wat komen gaat
Wat zorgde voor de recordhittegolf in Perth en waarom het een voorproefje is van wat komen gaat Waarom is de aarde zo biologisch divers? Bergen bieden het antwoord
Waarom is de aarde zo biologisch divers? Bergen bieden het antwoord
Hoofdlijnen
- Wat zijn de rollen van tweede boodschappers in signaaltransductieroutes?
- Wat zijn de reactantenproducten en basisfuncties van aerobe anaërobe cellulaire ademhaling?
- Hoe vaccineer je een honingbij? Zes vragen beantwoord over een nieuw instrument om bestuivers te beschermen
- Paleobotanisten identificeren wat de mythische 'eerste bloem' zou kunnen zijn
- Hoe organiseren wetenschappers?
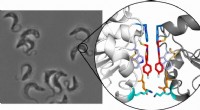
- Nieuwe structuren bieden inzicht in hoe een bacteriële motor bacteriële chemotaxis aandrijft, een belangrijk infectieus proces
- Hoe noem je een woord van 3 letters op mRNA -molecuul?
- Je lichaam doneren aan de wetenschap wordt steeds populairder in de VS
- Welke orgel slaat een mix van afval en water op totdat het klaar is om het lichaam te verlaten?
- Nieuwe therapeutische aanpak om Afrikaanse slaapziekte te bestrijden
- Zeep van stro - wetenschappers ontwikkelen milieuvriendelijk ingrediënt uit landbouwafval

- Collageen-nanofibrillen in weefsels van zoogdieren worden sterker bij inspanning

- Interdisciplinaire interacties inspireren nieuwe ontdekkingen

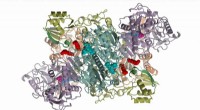
- Moleculaire machinerie die krachtige antibiotica maakt onthuld na tientallen jaren van onderzoek
 Een nieuwe strategie om onvolkomenheden in bezettingsrasterkaarten te corrigeren
Een nieuwe strategie om onvolkomenheden in bezettingsrasterkaarten te corrigeren Bij standaarddruk heeft een bepaalde verbinding een laag kookpunt en is het onoplosbaar in water STP dit waarschijnlijk bestaat als?
Bij standaarddruk heeft een bepaalde verbinding een laag kookpunt en is het onoplosbaar in water STP dit waarschijnlijk bestaat als?  Onthulling van de nauwkeurigheid van tsunami-voorspellingen
Onthulling van de nauwkeurigheid van tsunami-voorspellingen Wat is de kracht die in tegengestelde bewegingsrichting werkt?
Wat is de kracht die in tegengestelde bewegingsrichting werkt?  Beschrijf en onderscheid tussen gerepliceerde chromosomen homologe chromosomen?
Beschrijf en onderscheid tussen gerepliceerde chromosomen homologe chromosomen?  Theorie en praktijk sleutel tot geoptimaliseerde breedband, optische metamaterialen met weinig verlies
Theorie en praktijk sleutel tot geoptimaliseerde breedband, optische metamaterialen met weinig verlies Hoeveel elektronen zijn er nodig om een lading van 80qC (microcoulombs) te maken?
Hoeveel elektronen zijn er nodig om een lading van 80qC (microcoulombs) te maken?  Grote verschuiving van de Pacific Walker Circulation over het Cenozoïcum
Grote verschuiving van de Pacific Walker Circulation over het Cenozoïcum
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

