
Wetenschap
Nieuwe therapeutische aanpak om Afrikaanse slaapziekte te bestrijden
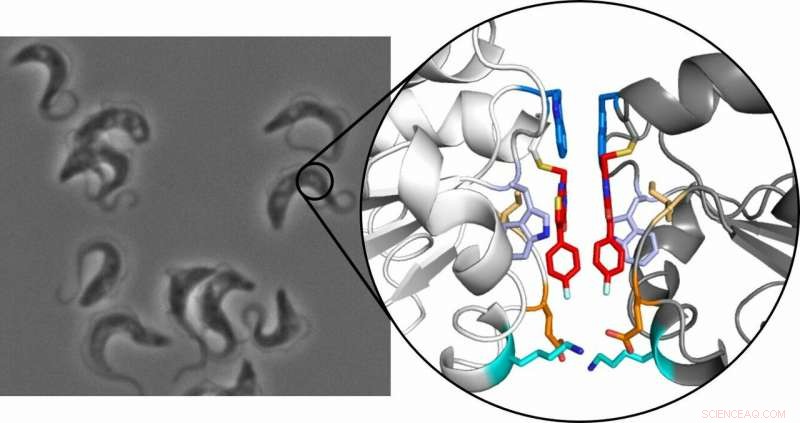
trypanosomen, die Afrikaanse slaapziekte veroorzaken, onder de microscoop (links) en de kristalstructuur van het tryparedoxine-dimeer (rechts):De twee remmermoleculen zijn rood gemarkeerd. Krediet:Ute Hellmich, Annika Wagner
Wetenschappers uit verschillende disciplines hebben hun krachten gebundeld om een nieuwe aanpak te vinden om de Afrikaanse slaapziekte te bestrijden. Fundamenteel onderzoek onder supervisie van professor Ute Hellmich van de Johannes Gutenberg Universiteit Mainz (JGU) heeft een veelbelovende strategie onthuld om een geschikt middel te ontwikkelen. "Er is nog een lange weg te gaan voordat we tot een farmaceutisch product komen, " zei Hellmich. "Maar ons zeer interdisciplinaire werk met betrekking tot parasitologie, theoretische en organische chemie, structurele biologie, en biochemie heeft laten zien hoe de parasiet die slaapziekte veroorzaakt onschadelijk kan worden gemaakt." De onderzoekers slaagden erin aan te tonen hoe een specifieke remmende stof aanmeert en een vitaal eiwit van de parasiet deactiveert.
Afrikaanse slaapziekte wordt veroorzaakt door trypanosomen, eencellige protozoën overgedragen door de beet van een geïnfecteerde tseetseevlieg. Volgens de Wereldgezondheidsorganisatie, het aantal besmette mensen is de afgelopen jaren afgenomen, naar schatting 15, 000 in 2014. Echter, het vaststellen van de werkelijke incidentie van de ziekte is moeilijk, omdat de vroege symptomen vergelijkbaar zijn met die van malaria. "Niet alleen de armste mensen in Afrika bezuiden de Sahara worden bedreigd, maar ook hun vee, die op dramatische schaal worden aangetast door bepaalde soorten Trypanosoma brucei, " verklaarde biochemicus professor Ute Hellmich.
Momenteel, slechts een handvol medicijnen om slaapziekte te behandelen, die dodelijk is indien onbehandeld, zijn beschikbaar en deze behandelingen gaan vaak gepaard met ernstige bijwerkingen en zelfs dodelijke afloop bij maximaal 10 procent van de patiënten. Hoewel er momenteel nieuwe medicijnen worden ontwikkeld, de aanpak van Hellmich's groep gaat nog een stap verder:"Onze remmer opent het toekomstperspectief om op een fundamenteel niveau remmers te kunnen ontwerpen en zou dus mogelijk ook kunnen worden gebruikt bij de behandeling van infectie met andere, verwante pathogene parasieten, zoals Leishmania, " zei Annika Wagner, hoofdauteur van de studie die onlangs is gepubliceerd in Internationale editie van Angewandte Chemie .
Remmer induceert dimerisatie van essentieel parasieteiwit
Het principe is gebaseerd op het feit dat een kleine, selectieve remmer bindt aan het enzym tryparedoxine. Dit eiwit is essentieel voor de parasiet, beschermen tegen oxidatieve schade, maar is niet aanwezig bij mensen, waardoor het een levensvatbaar medicijndoelwit wordt. Tot hun verbazing, ontdekte het team van onderzoekers dat wanneer de remmer zich aan het eiwit bindt, twee van de resulterende remmer-eiwitcomplexen combineren vervolgens om een stabiel dimeer te vormen. Wanneer dit gebeurt, het gewoonlijk monomere eiwit houdt op te functioneren.
"We waren verbaasd en dachten aanvankelijk dat het een toevalseffect was vanwege experimentele omstandigheden, " zei Hellmich. Het onderzoek werd toen uitgebreid, en in een grootschalig onderzoek met behulp van verschillende methoden werd geverifieerd dat het dimerisatie-effect kon worden gereproduceerd. Naast de Mainz-onderzoeksteams van professor Ute Hellmich en professor Till Opatz, onderzoekers van de universiteiten van Frankfurt, Würzburg, Heidelberg, en het European Molecular Biology Laboratory (EMBL) in Grenoble waren hierbij betrokken.
Zeer interdisciplinair onderzoek blijkt succesvol
De dimerisatie die het onderzoek aan het licht heeft gebracht, is ongebruikelijk omdat de verantwoordelijke molecule extreem klein is. De meeste moleculen die werken als een moleculaire kleefstof om individuele monomeren te combineren om een dimeer te vormen, zijn relatief groot. "Ons molecuul is veel kleiner en kan het eiwit direct herkennen, ", legt Hellmich uit. Kleine moleculen zijn ook gemakkelijker in cellen te smokkelen, wat het startpunt zou kunnen zijn voor nieuwe geneesmiddelenconcepten.
Door precies het mechanisme aan te tonen waarmee het parasieteiwit chemisch wordt geremd en gedimeriseerd door het kleine molecuul, het interdisciplinair onderzoekspartnerschap heeft de fundamenten van zo'n nieuw concept uitgestippeld. "Het was cruciaal dat we niet stopten bij ons oorspronkelijke doel om alleen de kristalstructuur van het eiwitremmercomplex te bepalen, "zei Hellmich. "In plaats daarvan, we hebben het resultaat nog eens bekeken en besproken met experts uit verschillende vakgebieden. Onderzoek komt pas verder als we samenwerken."
 Wat is de functie van een Tris-buffer in DNA-extractie?
Wat is de functie van een Tris-buffer in DNA-extractie?
Tris, of tris (hydroxymethyl) aminomethaan, is een algemene biologische buffer die tijdens het gehele DNA-extractieproces wordt gebruikt. Tijdens extractie uit een willekeurig aantal bronnen i
 Moleculaire schakelaar maakt fotomechanisch springen van polymeren mogelijk
Moleculaire schakelaar maakt fotomechanisch springen van polymeren mogelijk Nieuwe methode elimineert interferentie van nicotine bij detectie van methamfetamine
Nieuwe methode elimineert interferentie van nicotine bij detectie van methamfetamine Wat vertegenwoordigt het periodenummer?
Wat vertegenwoordigt het periodenummer?  Het onthullen van verborgen fasen van materie door de kracht van licht
Het onthullen van verborgen fasen van materie door de kracht van licht
 Oude veranderingen langs de Hudson bieden een glimp van hoe ijskappen groeiden
Oude veranderingen langs de Hudson bieden een glimp van hoe ijskappen groeiden Kunstmatige intelligentie gebruiken om risicovolle dammen te lokaliseren
Kunstmatige intelligentie gebruiken om risicovolle dammen te lokaliseren Het potentieel van palmolie om armoede te verlichten hangt af van waar het wordt verbouwd
Het potentieel van palmolie om armoede te verlichten hangt af van waar het wordt verbouwd Duizenden bestrijden bosbranden die Californische sequoia's bedreigen
Duizenden bestrijden bosbranden die Californische sequoia's bedreigen Hoe doen felle kleuren een beroep op kinderen?
Hoe doen felle kleuren een beroep op kinderen?
Hoofdlijnen
- Soorten Agar-platen
- Welke drie dingen helpen bloed door aderen te duwen?
- Wat hebben alle levende organismen gemeen?
- Anabolisch versus katabolisch (celmetabolisme): definitie en voorbeelden
- Betere mensen maken - Het huwelijk tussen mens en machine
- Nieuw onderzoek dat kankerremmende eiwitten koppelt aan celantennes
- Nieuwe mobiele app diagnosticeert gewasziekten in het veld en waarschuwt boeren op het platteland
- Een ezelsverhaal:Nigeria wordt de belangrijkste exporthub voor verstoppingen
- Nieuwe mechanismen ontdekt die bacteriën gebruiken om zichzelf te beschermen tegen antibiotica
- Prestaties van vaste katalysator voor methaanomzetting worden voorspeld door theoretische berekening
- Aerogels voor zonne-apparaten en ramen
- Moleculair jodium katalyseert processen voor antivirale en farmaceutische syntheses
- Tarwegluten kunnen worden gebruikt om duurzaam luiermateriaal te maken

- Nieuw ontwerp van roterende vloeistofreactor lost problemen op met huidige reactoren

 Wanneer zal Mars dicht bij de aarde zijn?
Wanneer zal Mars dicht bij de aarde zijn? Beelden gemaakt van relativistische elektronen gevangen in grafeen kwantumstippen
Beelden gemaakt van relativistische elektronen gevangen in grafeen kwantumstippen Onderzoekers stemmen wrijving in ionische vaste stoffen af op nanoschaal
Onderzoekers stemmen wrijving in ionische vaste stoffen af op nanoschaal Vurige waarneming:een nieuwe fysica van uitbarstingen die fusie-experimenten beschadigen
Vurige waarneming:een nieuwe fysica van uitbarstingen die fusie-experimenten beschadigen Hoe een Celestron Telescope
Hoe een Celestron Telescope Nikkel-78 bevestigd dubbel magisch te zijn
Nikkel-78 bevestigd dubbel magisch te zijn Verzameling van korte verhalen om lezers te verstrikken in de kwantumwereld
Verzameling van korte verhalen om lezers te verstrikken in de kwantumwereld Wat eten bliksembeestjes?
Wat eten bliksembeestjes?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Spanish | Portuguese | Swedish | Dutch | Danish | Norway | Italian | German |

-
Wetenschap © https://nl.scienceaq.com

