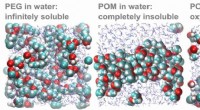
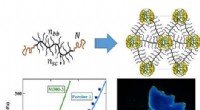
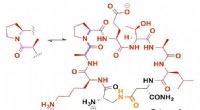
Wetenschap
Zuurstof als een gemeenschappelijk oxidatiemiddel?
* elektronegativiteit: Zuurstof is zeer elektronegatief, wat betekent dat het een sterke neiging heeft om elektronen aan te trekken.
* Oxidatie stelt: Zuurstof bestaat meestal in een -2 -oxidatietoestand, wat betekent dat het gemakkelijk elektronen van andere atomen accepteert.
* overvloed: Zuurstof is het meest voorkomende element in de korst van de aarde, waardoor het direct beschikbaar is voor reacties.
Voorbeelden van zuurstof als oxidatiemiddel:
* verbranding: Het verbranden van brandstoffen zoals hout, propaan en aardgas omvat zuurstof dat reageert met de brandstofmoleculen, waardoor energie wordt vrijgelaten in de vorm van warmte en licht.
* roesten: Wanneer ijzer reageert met zuurstof en water, vormt dit ijzeroxide (roest). Dit is een veel voorkomend voorbeeld van corrosie.
* ademhaling: In levende organismen wordt zuurstof gebruikt in cellulaire ademhaling om glucose af te breken en energie te produceren.
* Industriële processen: Zuurstof wordt gebruikt in veel industriële processen, zoals stalen, lassen en chemische synthese.
Sleutelpunten:
* oxidatie: In een chemische reactie verwijst oxidatie naar het verlies van elektronen.
* oxidatiemiddel: De stof die ervoor zorgt dat een andere stof wordt geoxideerd, wordt een oxidatiemiddel genoemd.
* reductie: De winst van elektronen wordt reductie genoemd.
Samenvattend: De hoge elektronegativiteit en de neiging van zuurstof om elektronen te accepteren, maken het een uitstekend oxidatiemiddel, waardoor talloze chemische reacties in de natuur en de industrie drijven.
 NASA vindt regen van tropische depressie Buds boven het vasteland van Mexico
NASA vindt regen van tropische depressie Buds boven het vasteland van Mexico 'Eat, Poop, Die':het boek van een onderzoeker onderzoekt hoe dieren onze wereld maken
'Eat, Poop, Die':het boek van een onderzoeker onderzoekt hoe dieren onze wereld maken  Wat is een overstroming van 100 jaar? Een hydroloog legt uit:
Wat is een overstroming van 100 jaar? Een hydroloog legt uit: Wat verslijt de aarde en verandert zijn landschap?
Wat verslijt de aarde en verandert zijn landschap?  Is de bladverliezende bosgrond rijk of arm?
Is de bladverliezende bosgrond rijk of arm?
Hoofdlijnen
- Jeugddieet kan bijdragen aan aangetaste verstandskiezen, blijkt uit onderzoek
- Waar zijn stamcellen gevonden?
- Sikkelcelanemie is een ziekte die wordt aangenomen door autosomale recessieve erfenis. Wat is de kans dat die persoon die twee ouders heeft, een drager van het defect gen zal zijn?
- Waarom is fotosynthese belangrijk voor mensen?
- Snellere Salmonella-test verhoogt voedselveiligheid voor mens en dier
- Wat is Tastile Stimulation?
- Welke rol speelt DNA in een organisme?
- Studie ontdekt hoe een systeem van eiwitten Salmonella helpt overleven in macrofagen
- Organismen die permanent zijn bevestigd aan een oppervlak dat wordt genoemd?
 Is 'superbreedband' de moeite waard voor bedrijven?
Is 'superbreedband' de moeite waard voor bedrijven?  Slangen met een geblokte buik
Slangen met een geblokte buik Waarom is klimaatscepticisme zo succesvol in de Verenigde Staten?
Waarom is klimaatscepticisme zo succesvol in de Verenigde Staten? Onderzoekers stellen een benchmark vast voor nauwkeurige bepaling van interne afmetingen binnen individuele moleculen
Onderzoekers stellen een benchmark vast voor nauwkeurige bepaling van interne afmetingen binnen individuele moleculen Hoe zijn lytische en lysogene cycli hetzelfde?
Hoe zijn lytische en lysogene cycli hetzelfde?  NASA vindt zware regenval in tropische storm Dorian
NASA vindt zware regenval in tropische storm Dorian Museumexemplaren, moderne steden laten zien hoe een insectenplaag zal reageren op klimaatverandering
Museumexemplaren, moderne steden laten zien hoe een insectenplaag zal reageren op klimaatverandering  Grote hindernis genomen voor organische zonnecellen
Grote hindernis genomen voor organische zonnecellen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com